CAMBIOS ENERGÉTICOS INVOLUCRADOS EN LAS REACCIONES QUÍMICAS (ΔH°REACCIÓN)
Entalpía
Cuando hay cambios químicos puede liberarse o absorberse energía en forma de calor. De igual forma pueden hacer que se efectúe trabajo sobre o desde el sistema. Por lo regular las reacciones en el laboratorio se hacen a presión constante (atmosférica). En estas circunstancias, se efectúa trabajo mecánico cuando se produce o consume un gas en la reacción. La función termodinámica llamada entalpía (H) representa el flujo de calor en cambios químicos que se efectúan a presión constante.
La entalpía es igual a la energía interna (E) más el producto de la presión (P) y el volumen (V) del sistema:
H = E + PV
La entalpía es una función de estado porque tanto la energía interna, la presión y el volumen son funciones de estado. Si se efectúa un cambio a presión constante. Entonces,
ΔH = ΔE + PΔV
Es decir, el cambio de entalpía (ΔH) está dado por el cambio de energía interna (ΔE) más el producto de la presión constante y el cambio de volumen (ΔV). El trabajo de expansión de un gas está dado por W = - PΔV, así que se puede sustituir - W por P ΔV en la ecuación. Además, se puede sustituir ΔE = q + W (cambio en la energía interna es igual al calor (q) más el trabajo (W) como se vio en la unidad 1) y obtener:
ΔH = q + W – W = q (calor a presión constante)
Así pues, el cambio de entalpía es igual al calor ganado o perdido a presión constante.
Si ΔH es positivo (es decir, si q es positivo), el sistema habrá ganado calor del entorno y es un proceso endotérmico. Si ΔH es negativo, el sistema habrá liberado calor al entorno y el proceso es exotérmico.
Entalpías de reacción:
Como ΔH es una función de estado depende sólo de los estados inicial y final del sistema, no de cómo se efectúa el cambio. Es decir,
ΔH = Hfinal - Hinicial
El cambio de entalpía para una reacción química está dado por la entalpía de los productos menos la de los reactivos:
ΔH = Hproductos – Hreactivos
Se le llama entalpía de reacción o simplemente calor de reacción al cambio de entalpía que acompaña a una reacción, y suele escribirse ΔHr, donde “r” es una abreviatura usada comúnmente para “reacción”.
ΔH se escribe al final de la ecuación balanceada, sin mencionar abiertamente la cantidad de sustancias que intervienen. Los coeficientes de la ecuación balanceada representan los números de moles de reactivos y productos que producen el cambio de entalpía. Las ecuaciones químicas balanceadas que presentan ΔH se denominan ecuaciones termoquímicas.
Ejemplo: 2H2(g) + O2(g) 2H2O(g) ΔH = - 483.6 kJ
Si se controla la reacción de modo que 2 mol de H2(g) reaccionen con 1 mol de O2(g) para formar 2 mol H2O(g) a presión constante, el sistema libera 483,6 kJ de calor (reacción exotérmica con ΔH negativo).
Para el caso: CO2(g) + 2H2O(l) CH4(g) + 2O2(g) ΔH = 890 kJ
En esta reacción para formar un mol de metano CH4(g) y dos moles de oxígeno a partir de 1 mol de CO2 y dos moles de agua, el sistema requiere absorber 890 kJ de calor, por lo que es una reacción endotérmica (ΔH positivo).
El cambio de entalpía de una reacción también se representa con un diagrama de entalpía dependiendo si el proceso es exotérmico (ΔH negativo) o endotérmico (ΔH positivo).
Para un proceso exotérmico:
La entalpía de los productos de la reacción es más baja que la de los reactivos. La entalpía del sistema es más baja después de la reacción porque se perdió energía en forma de calor liberado al entorno.
Mientras para un proceso endotérmico:
En este caso la entalpía de los productos de la reacción es más alta que la de los reactivos. La entalpía del sistema es más alta después de la reacción porque se absorbió energía en forma de calor del entorno.
En ambos diagramas, el sistema debe absorber cierta cantidad de energía inicialmente, para que la reacción se realice, a esta energía se le llama ENERGIA DE ACTIVACION (Ea). En otras palabras, es la energía mínima que se necesita para iniciar una reacción química. El valor de Ea varía de una reacción a otra.
Algunas características de la entalpía:
- La entalpía es una propiedad extensiva. Por tanto, la magnitud de ΔH es directamente proporcional a la cantidad de reactivo consumido en el proceso. Por ejemplo, en la combustión de metano para formar dióxido de carbono y agua, se produce 890 kJ de calor cuando 1 mol de CH4 se quema en un sistema a presión constante:
CH4(g) + 2O2(g) CO2(g) + 2H2O(l) ΔH = - 890 kJ
Si se duplica la cantidad de moles de reactivo al doble, la combustión de 2 mol de CH4 con 4 mol de O2 se liberará el doble de calor, 1780 kJ.
2CH4(g) + 4O2(g) 2CO2(g) + 4H2O(l) ΔH = - 1780 kJ
- El cambio de entalpía para una reacción tiene la misma magnitud, pero signo opuesto que el ΔH para la reacción inversa. Cuando se invierte una reacción, se invierten los papeles de los productos y los reactivos; entonces, los reactivos de una reacción se convierten en los productos de la reacción inversa, y viceversa. Sin embargo, la magnitud de ΔH es la misma, pero con un cambio de signo.
2H2O2(l) 2H2O(l) + O2(g) ΔH = -196 kJ
2H2O(l) + O2(g) 2H2O2(l) ΔH = +196 kJ
- El cambio de entalpía para una reacción depende del estado de los reactivos y de los productos. Por tanto, es importante especificar los estados de agregación de los reactivos y de los productos en las ecuaciones termoquímicas. Por ejemplo, el valor de ΔH es diferente si el producto de la combustión de metano es agua gaseosa en lugar de agua líquida.
CH4(g) + 2O2(g) CO2(g) + 2H2O(l) ΔH = - 890 kJ
CH4(g) + 2O2(g) CO2(g) + 2H2O(g) ΔH = - 802 kJ
Calorimetría:
Si se mide experimentalmente el flujo de calor se puede calcular valor de ΔH que acompaña a una reacción a presión constante. Al fluir calor desde o hacia un sistema, cambia la temperatura de la sustancia. Midiendo el cambio de temperatura que se produce se puede determinar el flujo de calor asociado a la reacción química.
Calorimetría se llama a medir el flujo de calor, se puede medir con un aparato que conocido como calorímetro.
Capacidad calorífica y calor específico:
Los objetos pueden emitir o absorber calor. Por ejemplo, el carbón al rojo vivo emite calor en forma de energía radiante; una compresa de hielo absorbe calor cuando se coloca sobre alguna inflación en la piel. La emisión o absorción de calor cambia la temperatura de los objetos. El cambio de temperatura que experimenta un objeto cuando absorbe energía está determinado por su capacidad calorífica, es decir la cantidad de calor necesaria para elevar su temperatura en 1 K (o 1ºC). Cuanto mayor es la capacidad calorífica de un objeto, más calor se necesita para producir una elevación de temperatura dada.
Para sustancias puras, la capacidad calorífica suele darse para cierta cantidad de la sustancia. La capacidad calorífica molar se denomina a la capacidad calorífica de 1 mol de una sustancia. La capacidad calorífica de 1 g de una sustancia es su capacidad calorífica específica (o simplemente su calor específico).
El calor específico de una sustancia se puede determinar experimentalmente midiendo el cambio de temperatura, ΔT, que experimenta una masa conocida, m, de la sustancia cuando gana o pierde una cantidad específica de calor.
Calor específico = calor transferido = q .
masa x cambio de temperatura m x ΔT
Por ejemplo, para incrementar en 1,00 K la temperatura de 50,0 g de agua se necesitan 209 J. Para calcular el calor específico del agua:
Calor específico = q = 209 J = 4,18 J/g-K
m x ΔT (50,0 g)(1,00 K)
También se puede calcular la cantidad de calor que una sustancia gana o pierde usando su calor específico junto con mediciones de su masa y del cambio de temperatura.
Calor transferido = Calor específico x masa x cambio de temperatura
Entalpías de formación:
Empleando algunos valores de ΔH tabulados se pueden calcular los cambios
de entalpía de una gran cantidad de reacciones. Por ejemplo, existen tablas de entalpías de vaporización (ΔH para convertir líquidos en gases), entalpías de fusión (ΔH para fundir sólidos), entalpías de combustión (ΔH para quemar una sustancia en oxígeno), etc.
El ΔH asociado a un proceso de formación de un compuesto partiendo de los elementos que lo constituyen se denomina entalpía de formación ΔHf (o calor de formación).
Para calcular el ΔHf se emplean datos termoquímicos tabulados. La magnitud de cualquier ΔH depende de las condiciones de temperatura, presión y estado de agregación de los reactivos y productos. Para poder comparar las entalpías de diferentes reacciones, se definen un conjunto de condiciones, llamadas estado estándar, que es su forma pura a presión atmosférica (1 atm) y la temperatura de interés, que por lo general se usa 298 K (25ºC). La entalpía estándar de una reacción se define como el cambio de entalpía cuando todos los reactivos y productos están en su estado estándar. Una entalpía estándar se denota como ΔHº, donde el superíndice º indica condiciones de estado estándar.
La entalpía estándar de formación de un compuesto ΔHfº, es el cambio de entalpía de la reacción que forma 1 mol del compuesto a partir de sus elementos, con todas las sustancias en su estado estándar. Si un elemento existe en más de una forma en las condiciones estándar, se usa la forma más estable del elemento para la reacción de formación.
Por definición, la ΔHfº de la forma más estable de cualquier elemento es cero, pues si el elemento ya está en su estado estándar no requiere una reacción de formación. Es decir, ΔHºf = 0 para cualquier elemento en su forma más estable en condiciones estándar.
Al descomponer cualquier reacción en reacciones de formación se obtiene el resultado general de que el calor estándar de reacción es la suma de los calores estándar de formación de los productos menos los calores estándar de formación de los reactivos:
ΔH°r = Σ n ΔHf ° (productos) - Σ m ΔHf ° (reactivos)
El símbolo Σ (sigma) significa “la suma de”, n y m son los coeficientes estequiométricos de la reacción. El primer término de la ecuación representa las reacciones de formación de los productos, el segundo término representa las reacciones de consumo de los reactivos.
Ejemplo Calcule el cambio de entalpía estándar para la combustión de 1 mol de benceno, C6H6(l), a CO2(g) y H2O(l).
C6H6(l) + 15/2 O2(g) 6CO2(g) + 3H2O(l) ΔH=?
Para calcular ΔHºr se requieren los datos de ΔHºf de los reactivos y productos, estos se encuentran en tablas de anexos en los libros de texto de Química.
En este caso:
ΔHºf [C6H6(l)] = 49,0 kJ
ΔHºf [O2(g)] = 0
ΔHºf [CO2(g)] = -393,5 kJ
ΔHºf [H2O(l)] = -285,8 kJ
Calculando:
ΔH°r = Σ n ΔHf ° (productos) - Σ m ΔHf ° (reactivos)
ΔHºr = [6 x ΔHºf (CO2) + 3x ΔHºf (H2O)] - [ΔHºf (C6H6) + 15/2 ΔHºf (O2)]
ΔHºr = [6(-393,5 kJ) + 3(-285,8 kJ)] - [(49,0 kJ) + 15/2 (0 kJ)]
ΔHºr = -3267 kJ para la combustión de 1 mol de benceno.
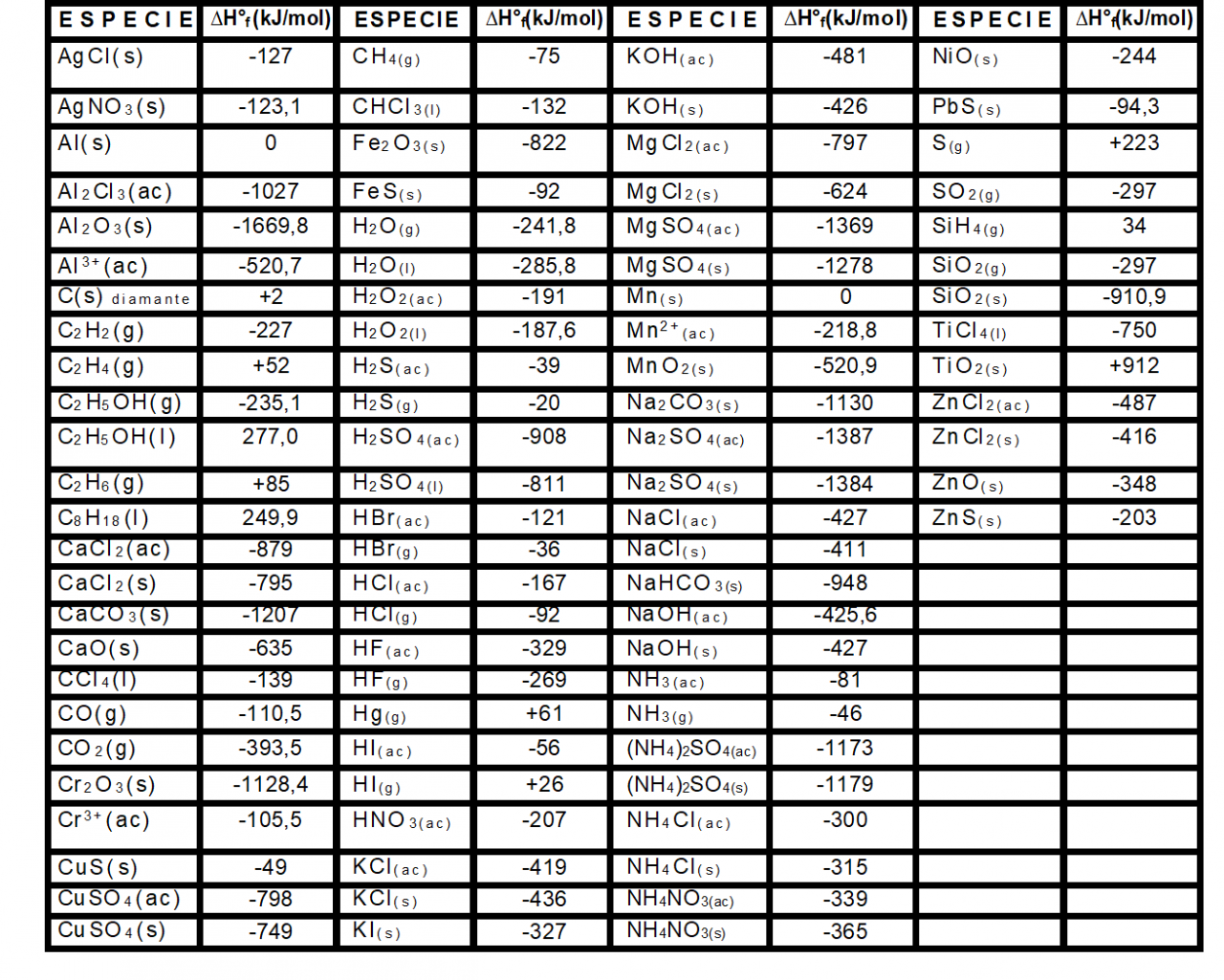
Entalpías normales de formación de algunas especies
Un CATALIZADOR es una sustancia que hace que aumente la velocidad de reacción. Al agregar esta sustancia al sistema de reacción, la reacción ocurre por un mecanismo diferente que disminuye la Energía de Activación. Por lo tanto, la Energía del Estado de Transición. Un catalizador es una sustancia que modifica la rapidez de una reacción química sin sufrir un cambio químico permanente en el proceso.
Un INHIBIDOR es una sustancia que disminuye la velocidad de reacción. Con esta sustancia, el mecanismo diferente aumenta la Energía de Activación y del Estado de Transición. En ambos casos estas sustancias se recuperan sin alteración al final.