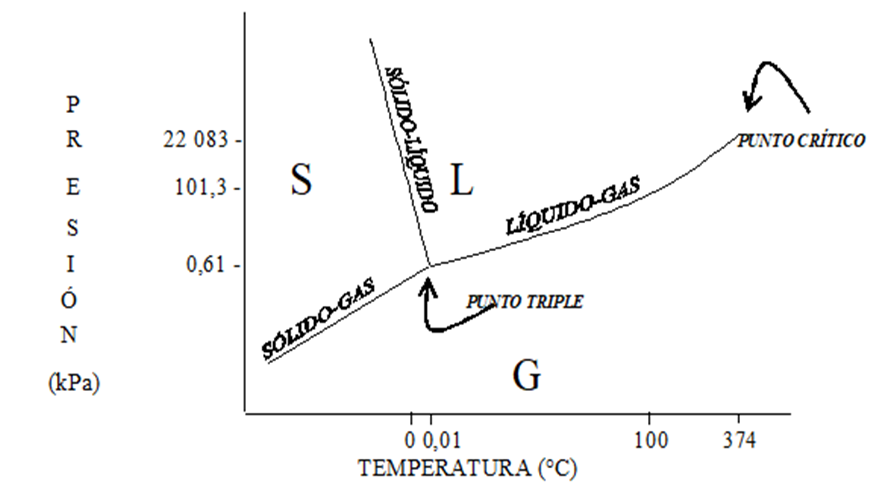
Los cambios de estado son cambios físicos de la materia, pueden ocurrir por cambios en la temperatura o de la presión o de ambos al mismo tiempo como se muestra en la figura.
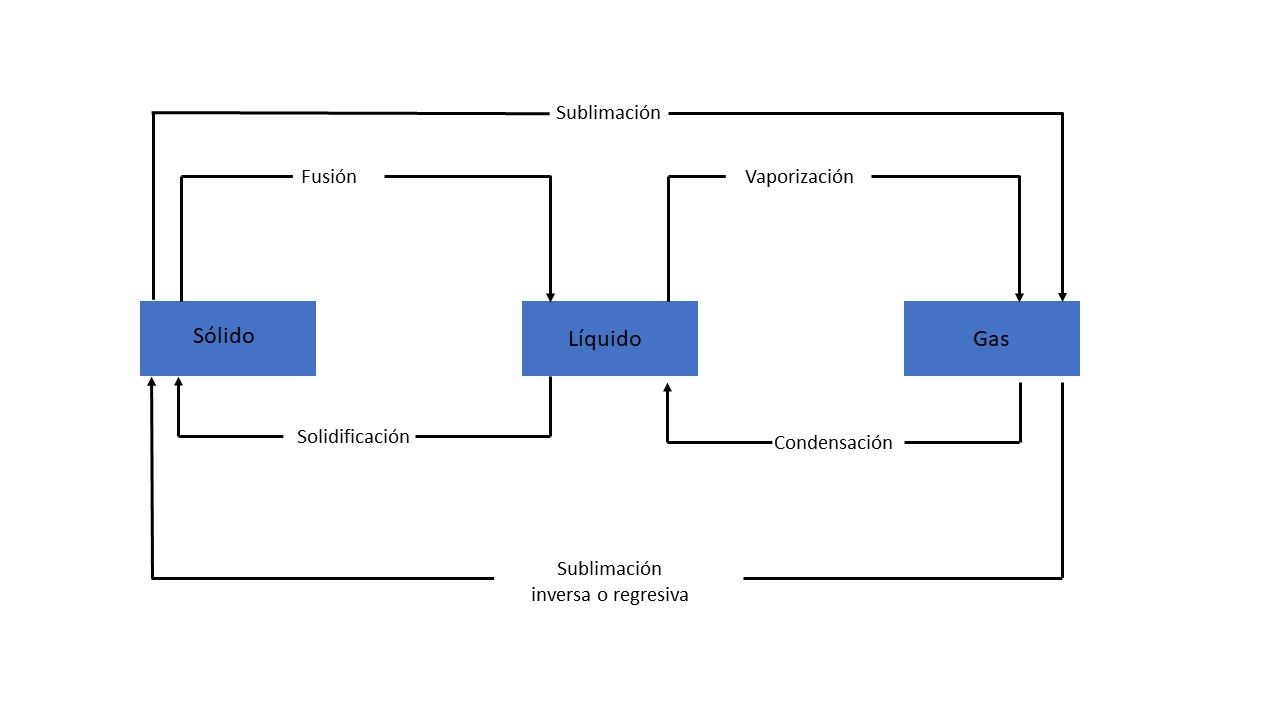
Todo cambio de fase se acompaña por un cambio en la energía del sistema. En un sólido (posiciones fijas), al aumentar la temperatura sus unidades componentes vibran con un movimiento cada vez más vigoroso. Cuando el sólido se derrite, sus unidades componentes quedan libres de moverse unas respecto a otras, lo cual generalmente implica que se separen. Este proceso se llama fusión. El aumento en la libertad de movimiento se mide por el calor de fusión o entalpía de fusión (ΔHfus).
Si la temperatura de la fase líquida sigue aumentando, las moléculas del líquido se mueven con mayor energía. La concentración de moléculas en fase gaseosa arriba del líquido aumenta con la temperatura. Estas moléculas ejercen una presión llamada presión de vapor. La presión de vapor aumenta al incrementar la temperatura, hasta igualar la presión atmosférica. En este punto, el líquido ebulle; es decir las moléculas del líquido pasan al estado gaseoso, donde están muy separadas unas de otras. La energía requerida para este proceso se denomina calor de vaporización o entalpía de vaporización (ΔHvap).
Las moléculas de un sólido pueden pasar directamente al estado gaseoso. El cambio de entalpía requerido para esta transición se denomina calor de sublimación (ΔHsub).
DIAGRAMA DE ESTADOS DE AGREGACIÓN, PUNTOS DE FUSIÓN, EBULLICIÓN, SUBLIMACIÓN, TRIPLE Y CRÍTICO. FLUIDOS SUPERCRÍTICOS
En condiciones apropiadas de temperatura y presión, un sólido puede estar en equilibrio con su estado líquido o incluso con su estado de vapor. Una manera gráfica de resumir condiciones en las que hay equilibrios entre los diferentes estados de la materia se conoce como diagrama de fases. También permite predecir la fase de una sustancia que es estable a una determinada temperatura o presión.
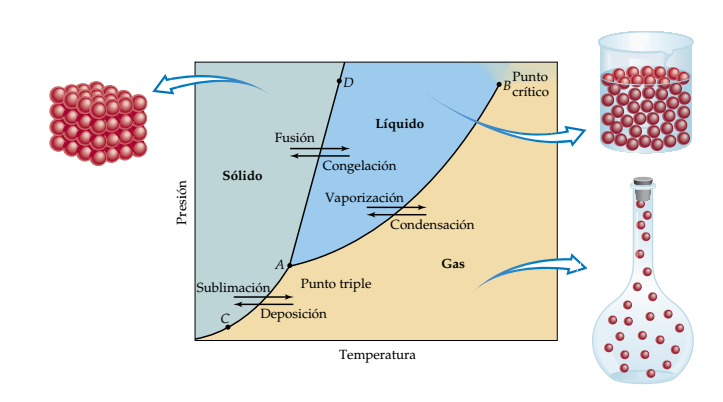
La figura muestra un diagrama de fases típico de una sustancia. Se aprecia una línea de A a B que es la curva de presión de vapor del líquido, el equilibrio entre las fases líquida y gaseosa se representa en esta curva. El punto normal de ebullición es el punto de esta curva en el que la presión de vapor es de 1 atm. La curva de presión de vapor termina en el punto crítico, (B), que está en la temperatura crítica y la presión crítica de la sustancia. Después del punto crítico, no se puede distinguir las fases líquida y gaseosa.
La línea de A a C representa la variación de la presión de vapor del sólido cuando sublima a diferentes temperaturas.
La línea de A hasta más allá de D simboliza el cambio del punto de fusión del sólido cuando aumenta la presión. El punto de fusión es el mismo a su punto de congelación. La única diferencia es la dirección al aproximarse al cambio de fase. El punto normal de fusión es el punto de fusión a 1 atm.
El punto A, donde se intersecan las tres curvas, se conoce como punto triple, donde las tres fases están en equilibrio a esta temperatura y presión. Cualquier otro punto de las tres curvas representa un equilibrio entre dos fases. Cualquier punto que no esté en una línea corresponde a condiciones en las que sólo está presente una fase.
En resumen:
Punto triple: corresponde a las únicas temperatura y presión a la cual están en equilibrio (coexisten) los tres estados de agregación.
Punto crítico: Corresponde a la temperatura y presión límites a las cuales existen en equilibrio el líquido y el gas.
La presión crítica es el valor límite al cual es posible licuar al gas por compresión.
Ejemplo: el agua bajo condiciones mayores de 374 °C y 22 083 kPa se encuentra como un fluido supercrítico, con características entre líquido y gas sin ser alguno de los dos.