ENLACE COVALENTE
Los elementos se unen y “comparten” sus electrones. Se da entre no metales -o sea, elementos que tienen electronegatividades similares. En este tipo de enlace no se forman iones.
Al compartir los electrones, comparten la estabilidad que correspondería a un gas noble.
Los átomos comparten pares de electrones. Máximo tres pares.
Naturaleza del enlace: Se traslapan los orbitales enlazantes de los átomos, compartiéndose los electrones. El enlace es dirigido; ocurre entre los átomos enlazados. Forma moléculas.
Existen dos tipos de enlaces covalentes:
- Enlace covalente normal.
- Enlace covalente coordinado.
En este tipo de enlace cada uno de los elementos aporta con un electrón al par que forma el enlace. Al ser elementos semejantes, son atraídos por sus núcleos en forma simultánea, formando el enlace.
ENLACE COVALENTE COORDINADO
En este tipo de enlace también se “comparte” una pareja de electrones. Pero la gran diferencia es que esta pareja proviene de tan solo uno de los átomos que forman el enlace. Un ejemplo de este tipo de enlace es la unión entre O y S, formando el dióxido de azufre, en donde el S cede su par de electrones al O.
ASPECTOS ADICIONALES DE LAS SUSTANCIAS COVALENTES
ESTRUCTURA DE LEWIS
El químico estadounidense G. N. Lewis sugirió una forma sencilla de representar los electrones de valencia de los átomos en la formación de enlaces, por medio de símbolos de Lewis. El símbolo de Lewis para un elemento consiste en el símbolo químico del elemento más un punto por cada electrón de valencia.
ESTRUCTURA DE PUNTOS DE LEWIS
Los electrones de valencia son los que participan en los enlaces químicos. Los electrones de valencia son los que residen en la capa exterior incompleta de los átomos.
Un químico de apellido Lewis sugirió una forma sencilla de representar los electrones de valencia de los átomos durante la formación de enlaces, usando símbolos de electrón-punto. El símbolo de Lewis para un elemento consiste en el símbolo químico del elemento más un punto por cada electrón de valencia. Por ejemplo, el azufre tiene la configuración electrónica [Ne]3s23p4; su símbolo de Lewis tiene seis electrones de valencia:
Las configuraciones electrónicas y los símbolos de Lewis de los elementos representativos se muestran en el cuadro 5.1.
REGLA DEL OCTETO
Los átomos tienden a ganar, perder o compartir electrones hasta estar rodeados por ocho electrones de valencia. Cada pareja de electrones compartidos forma un enlace. Se pueden formar enlaces sencillos, dobles y triples con el mismo átomo. Un octeto de electrones consiste en subcapas s y p llenas de un átomo.
¿CÓMO DIBUJAR ESTRUCTURAS DE LEWIS?
Para poder dibujar una estructura de Lewis es necesario seguir algunas reglas para establecer la estructura correcta de moléculas y iones compuestos con elementos representativos.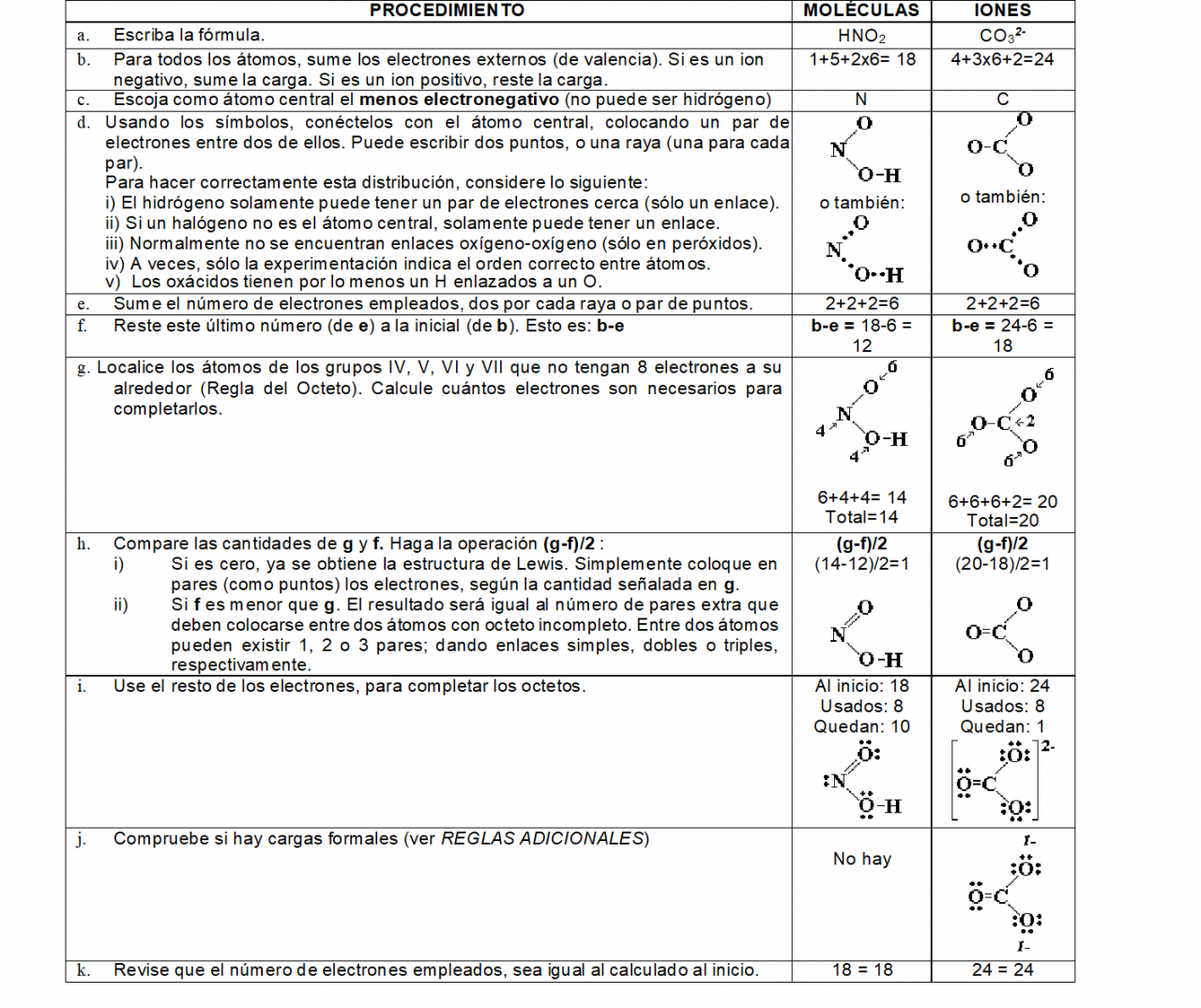
Reglas adicionales

CARGA FORMAL
Cuando se dibuja una estructura de Lewis, se describe la forma en que los electrones están distribuidos en una molécula (o ion). En algunos casos, es posible dibujar varias estructuras de Lewis distintas que obedezcan la regla del octeto. Para saber cuál de las estructuras es la más correcta, se calcula la carga formal de la molécula dibujada. La carga formal de un átomo es la carga que tendría el átomo en la molécula si todos los átomos tuvieran la misma electronegatividad (es decir, si todos los pares de electrones de enlace se compartieran equitativamente entre los átomos).
Para calcular la carga formal en una estructura de Lewis, asignamos los electrones al átomo como sigue:
1. Todos los electrones no compartidos (no enlazantes) se asignan al átomo en el que se encuentran.
2. Se asigna la mitad de los electrones enlazantes a cada átomo del enlace.
La carga formal de un átomo es igual al número de electrones de valencia que tiene el átomo aislado, menos el número de electrones asignado al átomo en la estructura de Lewis, es decir:
CF = electrones de valencia - [electrones de pares libres del átomo en la molécula + la mitad del número total de electrones que participan en enlaces covalentes]
En una molécula la suma de las cargas formales debe ser cero; en un ion compuesto, igual a la carga. El considerar a las cargas formales como un efecto desestabilizador, ayuda a establecer la mejor estructura de Lewis. En el caso del HCN, se prefiere como correcta, la estructura sin cargas formales. Al decidir entre una estructura con octeto expandido y una con cargas formales, se escoge la primera.
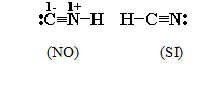
Otro ejemplo son las estructuras posibles para el CO2:
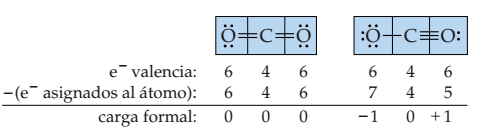
En este caso la primera estructura de Lewis es más correcta pues no presenta carga formal.
Otro ejemplo sería para el ácido sulfúrico H2SO4, se muestra una estructura con el octeto expandido para el azufre (posee orbitales d accesibles para expandir el octeto, hibridación spd3). Esta estructura es la más adecuada pues no presenta cargas formales en ninguno de sus elementos.

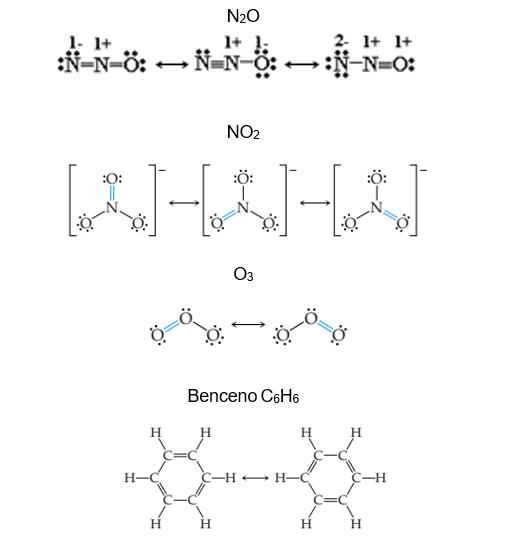
ESTRUCTURAS RESONANTES
Si solamente pueden obtenerse estructuras de Lewis con cargas formales y hay más de una manera de ubicar los dobles o triples enlaces, entonces las estructuras son de igual importancia.
Ejemplos:
HIBRIDACIÓN
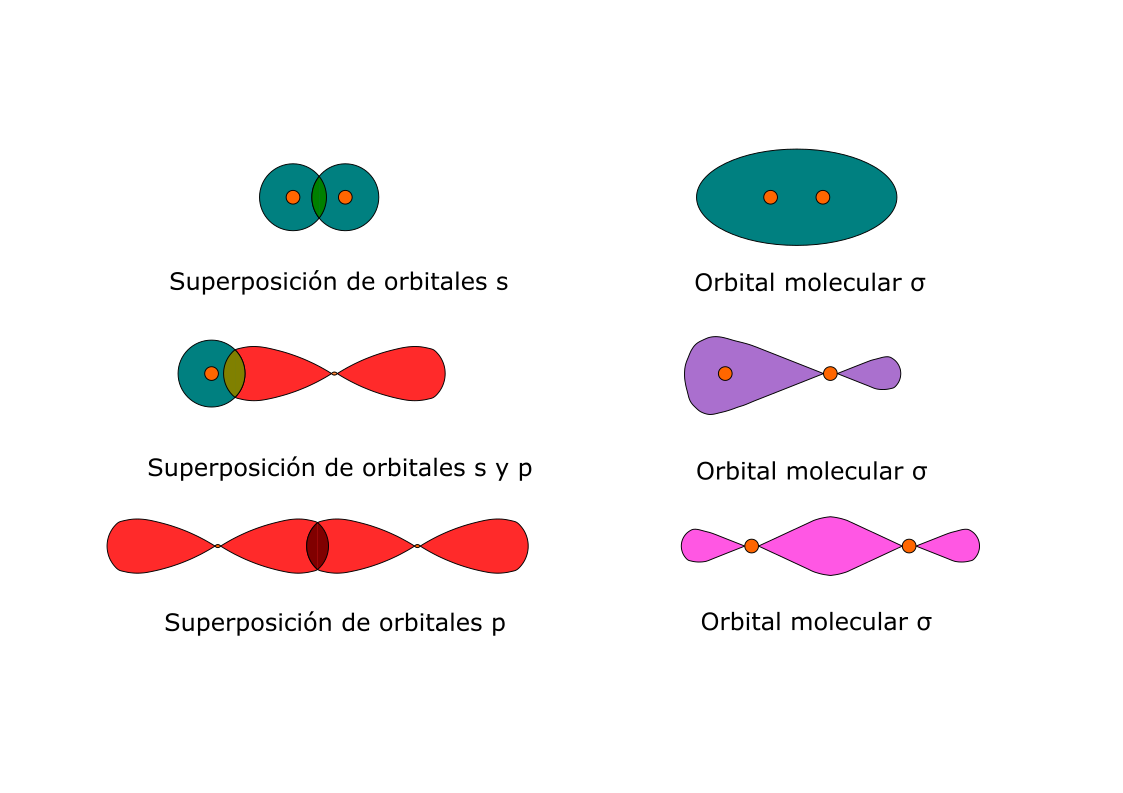
En la teoría de Lewis, cuando los átomos comparten electrones se forman enlaces covalentes. Es por esto que se concentra la densidad electrónica entre los núcleos. La acumulación de densidad electrónica entre dos núcleos ocurre cuando un orbital atómico de valencia de un átomo se fusiona con uno de otro átomo. Se dice entonces que los orbitales comparten una región del espacio, o que se traslapan (ver figura 5.5). El traslape de orbitales permite a dos electrones con espín opuesto compartir el espacio común entre los núcleos y formar así un enlace covalente.
Para explicar la geometría de las moléculas (ángulos y distancia) y la covalencia de ciertos átomos se formuló la “teoría de la hibridación”. Se basa en la suposición de que los enlaces covalentes se producen por solapamiento de los orbitales atómicos de distintos átomos y emparejamiento de los electrones de orbitales semi-ocupados.
Así, dos átomos de H (1s1) tienen cada uno un electrón desapareado en un orbital “s” y formarían un orbital molecular en donde alojarían los dos electrones. Se llama “covalencia” al número de electrones desapareados y por tanto al número de enlaces que un átomo forma.
ENLACE COVALENTE SIMPLE
Se produce un único solapamiento de orbitales atómicos. Es frontal y se llama “s” (sigma).
Puede ser:
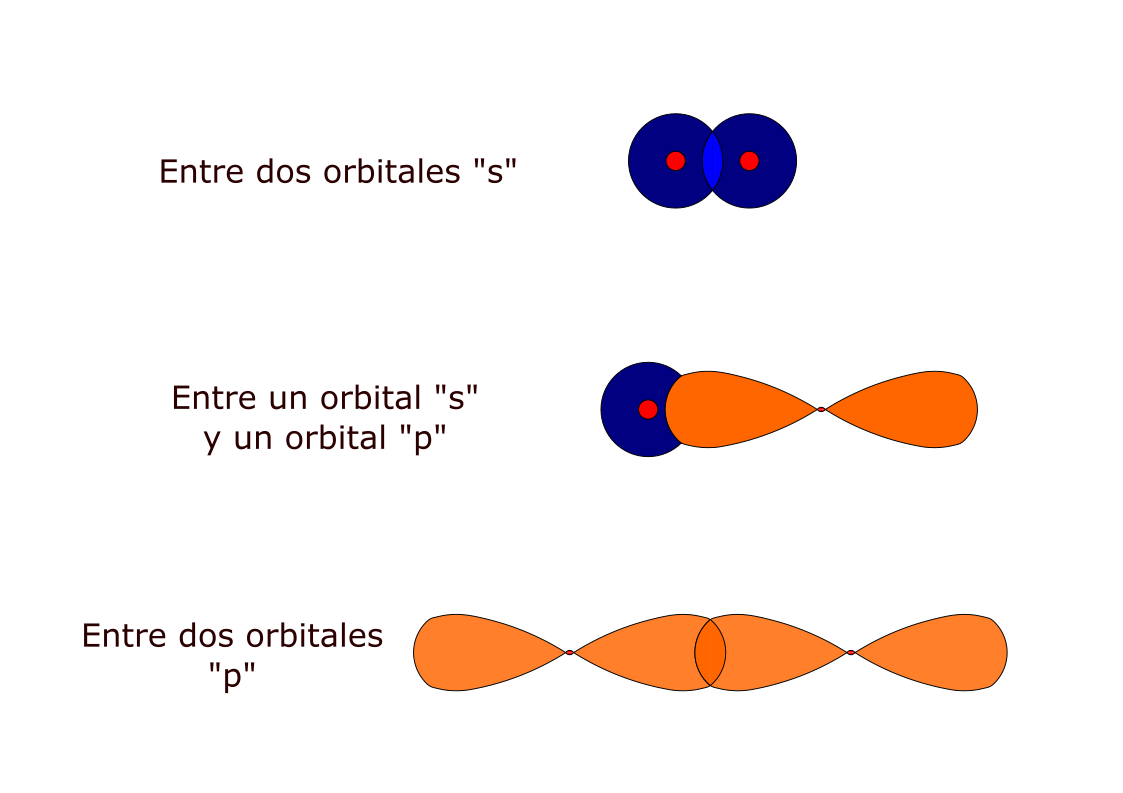
Se producen dos o tres solapamientos de orbitales atómicos entre dos átomos.
Siempre hay un enlace frontal “s” (sólo 1).
Si en enlace es doble, el segundo solapamiento es lateral “π” (pi).
Si el enlace es triple, existe un solapamiento “s” y dos “π”.
En la figura 5.6 se muestra una representación de un enlace doble en el eteno H2C=CH2 y una representación de un enlace triple en el etino HC=CH.
HIBRIDACIÓN DE ORBITALES ATÓMICOS
Se hibridan: Los orbitales atómicos que van a formar enlaces “s” y las parejas de electrones sin compartir.
No se hibridan: Los orbitales atómicos que van a formar el segundo o tercer enlace y los orbitales atómicos vacíos.
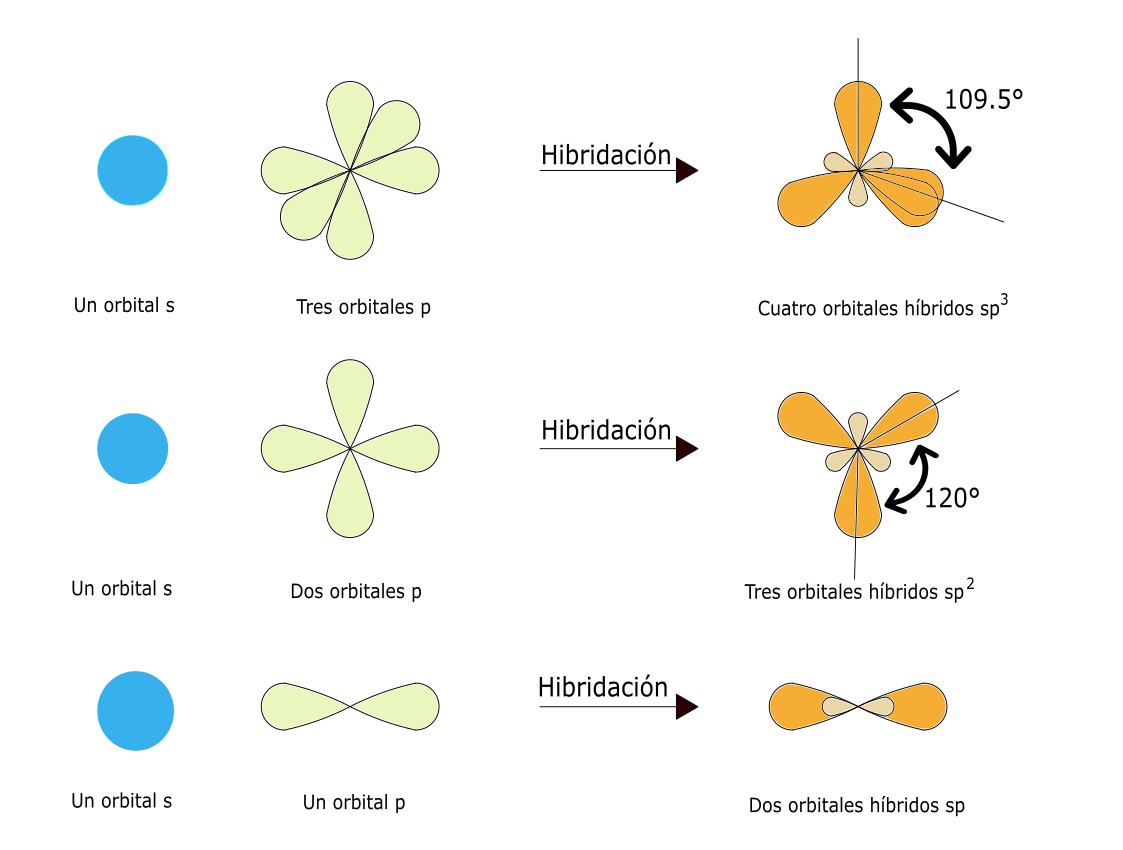
Por ejemplo, el carbono (C) forma cuatro enlaces en compuestos como el CH4 y en la mayoría de los compuestos que forma (para ello precisa promocionar el electrón del orbital 2s al 2p y a continuación formar 4 orbitales de igual energía a partir del 2s y de los 3 orbitales 2p) (ver ejemplo en la figura 5.7).
Hibridación sp3
4 enlaces sencillos. Ejemplo: metano CH4
3 enlaces sencillos + 1 par electrones sin compartir. Ejemplo: NH3
2 enlaces sencillos + 2 pares de electrones sin compartir. Ejemplo: H2O
Hibridación sp2
3 enlaces sencillos. Ejemplo: BF3
1 enlace doble y 2 sencillos. Ejemplo: C2H4
Hibridación sp
2 enlaces sencillos. Ejemplo: BeF2
2 enlaces dobles. Ejemplo: CO2
1 enlace triple y 1 sencillo. Ejemplo: C2H2