Este tipo de enlace ocurre entre átomos de metales. Los átomos de los metales tienen pocos electrones en su último nivel. Estos átomos pierden fácilmente estos electrones. Estos electrones forman una nube electrónica que está débilmente unida al núcleo. Los electrones externos de todos los átomos pertenecen por igual a todos los átomos.
Naturaleza del enlace: Los orbitales externos de los átomos, se traslapan y forman una "banda", en donde se localizan los electrones externos. El enlace no es dirigido. Forma agregados de átomos.
La unión de estos átomos tiene la forma de una red cristalina. Esta nube tiene una gran movilidad que lleva a que el enlace metálico es deslocalizado. Esto explicaría algunas características de los metales.
Un ejemplo de enlace metálico es Litio. Su único electrón de valencia está enlazado deslocalizadamente a los otros átomos, formando una red cristalina (ver figura).
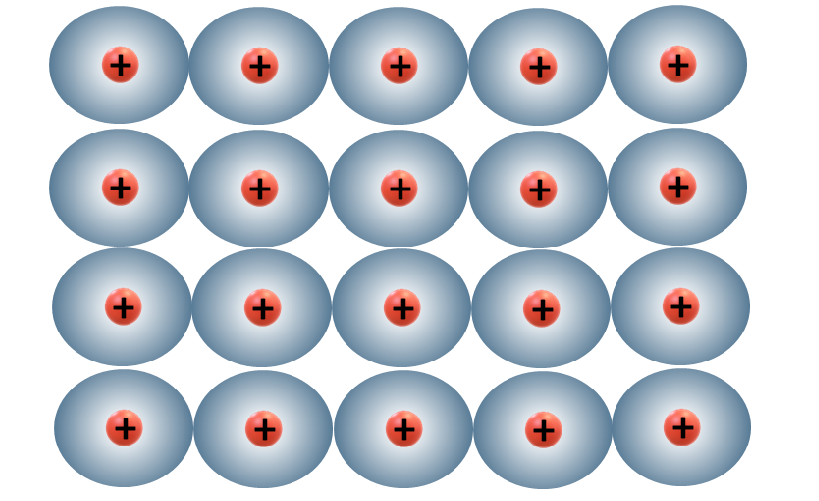
Cada esfera representa el núcleo y los electrones internos de un átomo metálico. La “nube” colorida que los rodea representa el mar móvil de electrones que une a los átomos.