ESTADOS DE AGREGACIÓN DE LA MATERIA, PROPIEDADES GENERALES Y PARTICULARES DE: SÓLIDOS, LÍQUIDOS Y GASES
Los estados de la materia pueden clasificarse en:
- Los estados CLÁSICOS: SÓLIDO, LIQUIDO y GASEOSO.
- Los estados NO-CLÁSICOS: PLASMA (gas caliente totalmente ionizado) y COLOIDE (soles, emulsiones, geles, aerosoles y espumas).
- Los estados HIPOTÉTICOS: existirían bajo condiciones de alto contenido energético, típicas de situaciones experimentales, en estrellas y fenómenos cósmicos.
Una muestra de materia puede ser gaseosa, líquida o sólida. Estas tres formas se denominan estados clásicos de agregación de la materia y se diferencian en algunas de sus propiedades observables. Un gas no tiene forma ni volumen definido; pues se ajusta al volumen y la forma del recipiente que lo contiene. Un líquido tiene un volumen definido, pero no tiene forma específica; toma la forma del recipiente que ocupa. Un sólido sí tiene forma y volumen definidos; es rígido. Ni los líquidos ni los sólidos pueden comprimirse de forma apreciable.
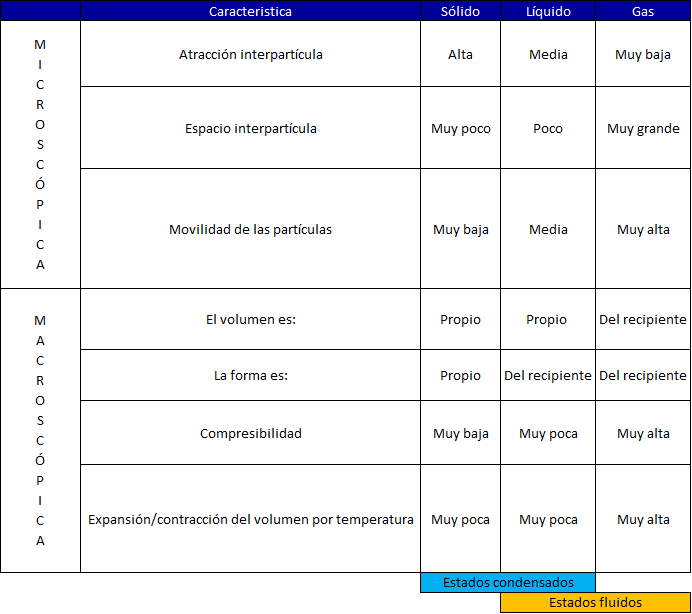
Propiedades Microscópicas y Macroscópicas
Los estados clásicos presentan ciertas propiedades como se muestran en el cuadro
Algunos ejemplos de alótropos:
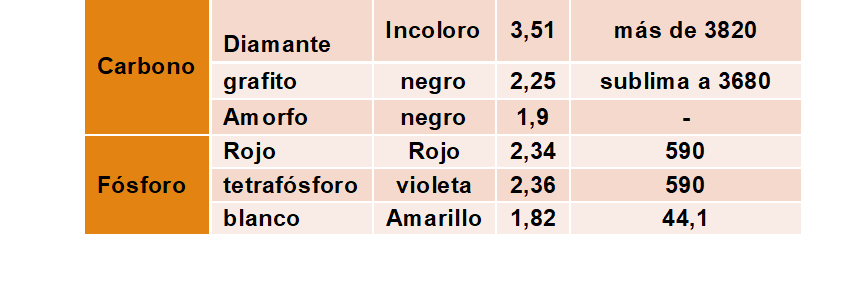
Otros muchos elementos presentan alotropía: estaño, oxígeno, azufre, helio, plutonio, selenio y otros.
PROPIEDADES DE SÓLIDOS
- En los sólidos las fuerzas de cohesión de las partículas son muy efectivas.
- Tienen poca movilidad.
- Vibran en posiciones fijas.
- Tienen forma y volumen propio
- Resisten las fuerzas de deformación.
Algunas partículas pueden escapar del sólido, lo que hace posible determinar su presión de vapor.
En sólidos cristalinos, el arreglo de sus partículas abarca a miles de ellas.
En sólidos amorfos, el orden solo abarca unas pocas partículas, este es el caso del vidrio y de los hules o elastómeros.
Dureza:
Permite comparar a las sustancias y decidir su uso:
- Resistencia a la erosión.
- El desgaste frente a otro material en piezas de motores o si es un buen abrasivo.
- Especificar características y describir su comportamiento.
PROPIEDADES DE LÍQUIDOS
- Sus partículas se atraen.
- Poco compresibles (volumen propio).
- Distancia inter-partícula mayor
- No tienen forma propia y pueden fluir
Menor cohesión; pueden desplazarse más lejos y no se acomodan en posiciones fijas.

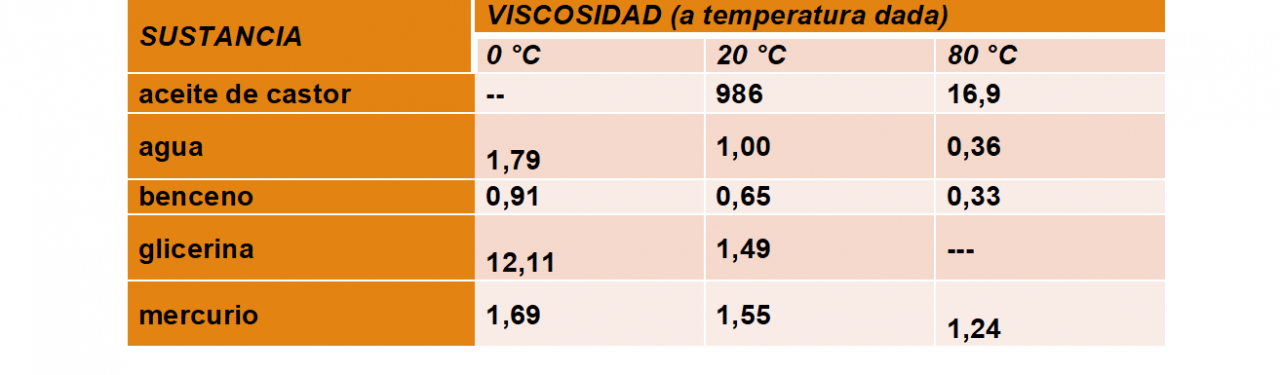
Viscosidad: cuando un líquido cambia su forma, fluye la atracción entre sus partículas produce una fricción interna llamada viscosidad, que tiende a resistir la fluidez. La viscosidad disminuye al aumentar la temperatura y al disminuir la presión.

Variación de la viscosidad de algunos líquidos con la temperatura.
Tensión Superficial
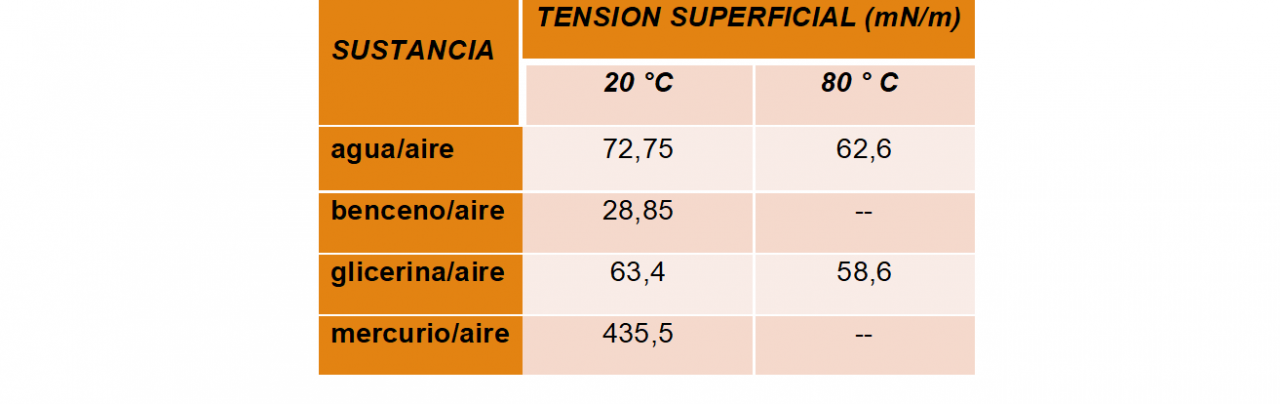
Por la cohesión entre sus partículas, en la superficie se origina una "membrana o película tensamente estirada". Debido a las atracciones un poco mayores que presentan las partículas de la superficie, que a diferencia de las del interior, no son atraídas por otras partículas en todas las direcciones.
La tensión superficial causa que los líquidos formen gotas y que presenten capilaridad. Al aumentar la temperatura, o la presencia de contaminantes como impurezas, causan que la tensión superficial disminuya.
Variación de la tensión superficial de algunas sustancias con la temperatura
Presión de Vapor: la energía cinética promedio de traslación de las partículas no es tan grande como para que puedan escapar unas de otras, superando las fuerzas de atracción. A cierta temperatura, solamente ciertas partículas, las más energéticas, logran "pasar" al estado gaseoso. Si se mide la presión que ejerce el gas, en equilibrio con el líquido a cierta temperatura en un sistema cerrado, se determina la PRESION DE VAPOR del líquido (volatilidad de la sustancia).
A mayor temperatura, mayor presión de vapor, hasta alcanzar la temperatura de ebullición, según la presión externa.
Variación de la presión de vapor de algunos líquidos con la temperatura
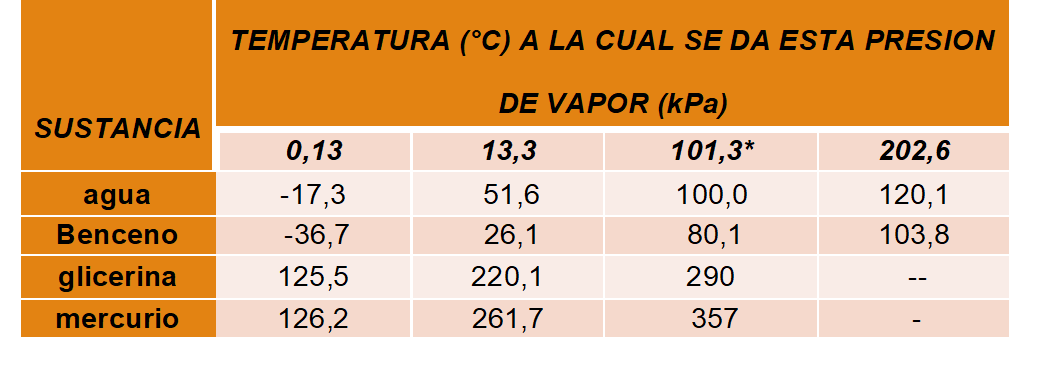
* Corresponde a la temperatura y presión de ebullición normal
PROPIEDADES DE GASES
- Las partículas interactúan muy poco entre sí
- Alta movilidad
- No definen un volumen o forma (ocupar todo el recipiente) o Alta compresibilidad (grandes distancias entre sus partículas y movilidad)
Alta difusibilidad con otros gases. o Presentan viscosidad.

GASES IDEALES
No todos los gases responden de igual manera a modificaciones en temperatura y presión, sin embargo, el comportamiento de los gases reales presenta algunos rasgos en común, lo cual permite estudiarlos bajo el modelo del GAS IDEAL
Cumplen con los postulados de la Teoría Cinética de los Gases:
- Todos están constituidos por partículas.
- Las partículas se consideran esferas de diámetro despreciable.
- Las partículas se mueven al azar, a diferentes velocidades.
- La velocidad de las partículas aumenta con la temperatura y viceversa.
- Las partículas chocan entre sí y contra las paredes del recipiente, sin pérdida de energía (choques elásticos).
Se considera el comportamiento de los gases reales, como ideales, aunque para un gas real, este comportamiento sólo se acerca a muy bajas presiones y altas temperaturas.
El estado de un gas está definido por las siguientes variables:
T = temperatura (en kelvin)
P = presión (en kilopascal)
V = volumen (en metro cúbico)
n = cantidad de materia (en mole)
Estas cuatro variables son necesarias para definir la condición física, o estado, de un gas, por medio de una expresión matemática conocida como la Ley de los Gases Ideales.
La relación presión-volumen: ley de Boyle:
“El volumen de una cantidad fija de gas mantenida a temperatura constante es inversamente proporcional a la presión”. Cuando dos mediciones son inversamente proporcionales, una disminuye cuando la otra aumenta. La ley de Boyle se puede expresar en términos matemáticos así:
P α 1/V
P x V = k (donde k es una constante)
P1 x V1 = P2 x V2
Dependiendo de la temperatura y de la cantidad de gas que hay en la muestra será el valor de la constante k. La gráfica de V contra P de la figura muestra el tipo de curva que se obtiene para una cantidad dada de gas a una temperatura constante. Cuando se grafica V contra 1/P se obtiene una relación lineal.
La relación temperatura-volumen: ley de Charles:
La ley de Charles dice que el volumen de una cantidad fija de gas a presión constante aumenta de forma lineal con la temperatura, como se muestra en la figura. Por lo tanto “el volumen de una cantidad fija de gas mantenida a presión constante es directamente proporcional a su temperatura absoluta”.
Variación del volumen de un gas con respecto a la temperatura se puede expresar con la siguiente expresión matemática:
T α V
V = k x T (donde k es una constate)
V1 / T1 = V2 / T2
La relación cantidad-volumen: ley de Avogadro:
El volumen de un gas depende no sólo de la presión y la temperatura, sino también de la cantidad de gas. La ley de los volúmenes de combinación : a una presión y temperatura dadas, los volúmenes de gases que reaccionan entre sí están en proporciones de números enteros pequeños. El volumen de un gas es directamente proporcional al número de moles del gas (a temperatura y presión constantes). Es decir,
V = k x n
Así, un aumento al doble del número de moles de gas (n) hará que el volumen (V) se duplique, si T y P permanecen constantes.
Ley de los gases ideales
Combinando las tres leyes se puede obtener la ecuación de los gases ideales.
P α nT/V
Si se le llama R a la constante de proporcionalidad, se obtiene:
P V = R n T
Donde R es la constante de proporcionalidad:
R = 0,082 l atm/(K mol) ó R = 8,3 kPa l/(K mol) ó R = 8,3 Pa m3/(K mol).
Esta ecuación se conoce como la ecuación del gas ideal. Un gas ideal es un gas hipotético cuyo comportamiento de presión, volumen y temperatura se describe perfectamente con la ecuación del gas ideal.