El estudio de las relaciones cuantitativas entre las fórmulas químicas y las ecuaciones químicas se denomina estequiometría. Uno de los conceptos importantes de la estequiometría es la ley de conservación de la masa, que dice que la masa total de los productos de una reacción química es igual a la masa total de los reactivos. Los mismos números de átomos de cada tipo están presentes antes y después de una reacción química representada mediante una ecuación química.
Pesos formulares: las fórmulas y ecuaciones químicas tienen un significado cuantitativo; los subíndices de las fórmulas y los coeficientes de las ecuaciones representan cantidades precisas. La fórmula H2O indica que una molécula de esta sustancia contiene exactamente dos átomos de hidrógeno y un átomo de oxígeno. Asimismo, la ecuación química balanceada para la combustión del propano:
C3H8(g) + 5O2(g) ⎯→ 3CO2(g) + 4H2O(g)
indica que la combustión de una molécula de C3H8 requiere cinco moléculas de O2 y produce exactamente tres moléculas de CO2 y cuatro de H2O. Sin embargo, ¿cómo se relacionan los números de átomos o moléculas con las cantidades que medimos en el laboratorio? Aunque no se puede contar directamente átomos ni moléculas, podemos determinar indirectamente los números si conocemos las masas.
El peso fórmula (PF) de una sustancia no es más que la suma de los pesos atómicos (PA) de cada uno de los átomos de su fórmula química.
Por ejemplo, el ácido sulfúrico (H2SO4) tiene un peso fórmula de 98.1 uma (Unidad de masa atómica). El peso fórmula también se llama peso molecular.
PF de H2SO4 = 2(PA de H) + 1(PA de S) + 4(PA de O)
= 2(1,O uma) + 32,1 uma + 4(16,0 uma) = 98,1 uma
Dado que las sustancias iónicas como el NaCl existen como matrices tridimensionales de iones, no es apropiado hablar de moléculas de NaCl. Más bien, hablamos de unidades formulares, representadas por la fórmula química de la sustancia. La unidad formular del NaCl consiste en un ion Na+ y un ion Cl -. Por tanto, el peso fórmula del NaCl es la masa de una unidad formular:
PF de NaCl = 23,0 uma + 35,5 uma = 58,5 uma
Se puede obtener abundante información cuantitativa de las fórmulas y ecuaciones químicas empleando pesos atómicos. El peso formular (PF) de un compuesto es igual a la suma de los pesos atómicos (PA) de los átomos incluidos en su fórmula. Si la fórmula es molecular, el peso fórmula también se denomina peso molecular. Los pesos atómicos y formulares pueden servir para determinar la composición elemental de un compuesto.
El mol
En química, la unidad para manejar el número de átomos, iones y moléculas en una muestra de tamaño ordinario es el mol, cuya abreviatura también es mol. Un mol es la cantidad de materia que contiene tantos objetos (átomos, moléculas o cualquier otro tipo de objetos que estemos considerando) como átomos hay en exactamente 12 g de 12C isotópicamente puro. Mediante experimentos se ha determinado que este número es 6,02 x1023. Este número se conoce como número de Avogadro.
Un mol de átomos, un mol de moléculas o un mol de cualquier otra cosa contiene el número de Avogadro de tales objetos: 1 mol de átomos de 12C = 6.02 x 1023 átomos de 12C, 1 mol de moléculas de H2O = 6.02 x 1023 moléculas de H2O 1 mol de iones NO3- = 6.02 x 1023 iones NO3-.
Una docena siempre es el número 12, sea que hablemos de una docena de huevos o de una docena de elefantes. No obstante, es obvio que una docena de huevos no tiene la misma masa que una docena de elefantes. De manera análoga, un mol siempre es el mismo número (6,02 x 1023), pero un mol de una sustancia y un mol de otra sustancia distinta tienen diferente masa.
Un mol de cualquier sustancia es el número de Avogadro (6,02 x 1023) de unidades formulares de esa sustancia. La masa de un mol de átomos, moléculas o iones es el peso fórmula de ese material expresado en gramos (la masa molar). Por ejemplo, la masa de una molécula de H2O es de 18 uma; por tanto, la masa molar del H2O es de 18 g/mol. Un mol siempre es el mismo número (6,02 x1023), pero un mol de una sustancia y un mol de otra sustancia distinta tienen diferente masa, conocida como su masa molar.
1 mol de átomos de 12C = 6,02 x1023 átomos de 12C
1 mol de moléculas de H2O = 6,02 x1023 moléculas de H2O
1 mol de iones NO3 - = 6,02 x1023 iones NO3 -
Un átomo de 12C tiene una masa de 12uma, un mol de 12C tiene una masa de 12 g
Un átomo de Cl tiene una masa de 35,5uma, un mol de Cl tiene una masa de 35,5g
Un átomo de Au tiene una masa de 197uma, un mol de Au tiene una masa de 197g
Relaciones molares de algunos elementos y compuestos
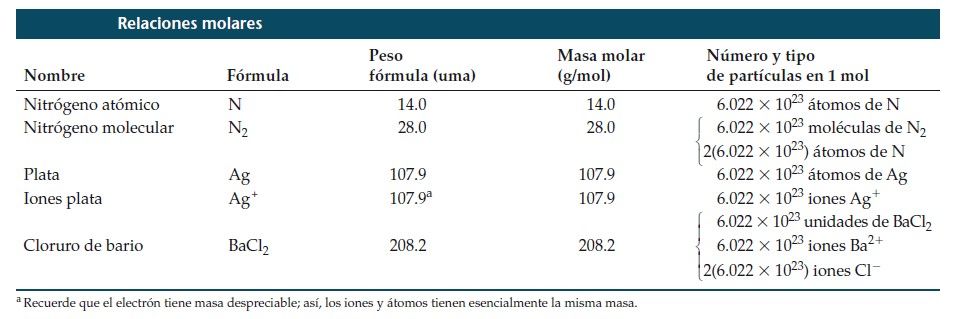
Masa Molar: la masa en gramos de un mol de una sustancia (es decir, la masa en gramos por mol) es su masa molar. La masa molar (en g/mol) de cualquier sustancia siempre es numéricamente igual a su peso formular (en uma). El NaCl, por ejemplo, tiene una masa molar de 58,5 g/mol.
Interconversión de masas, moles y números de partículas
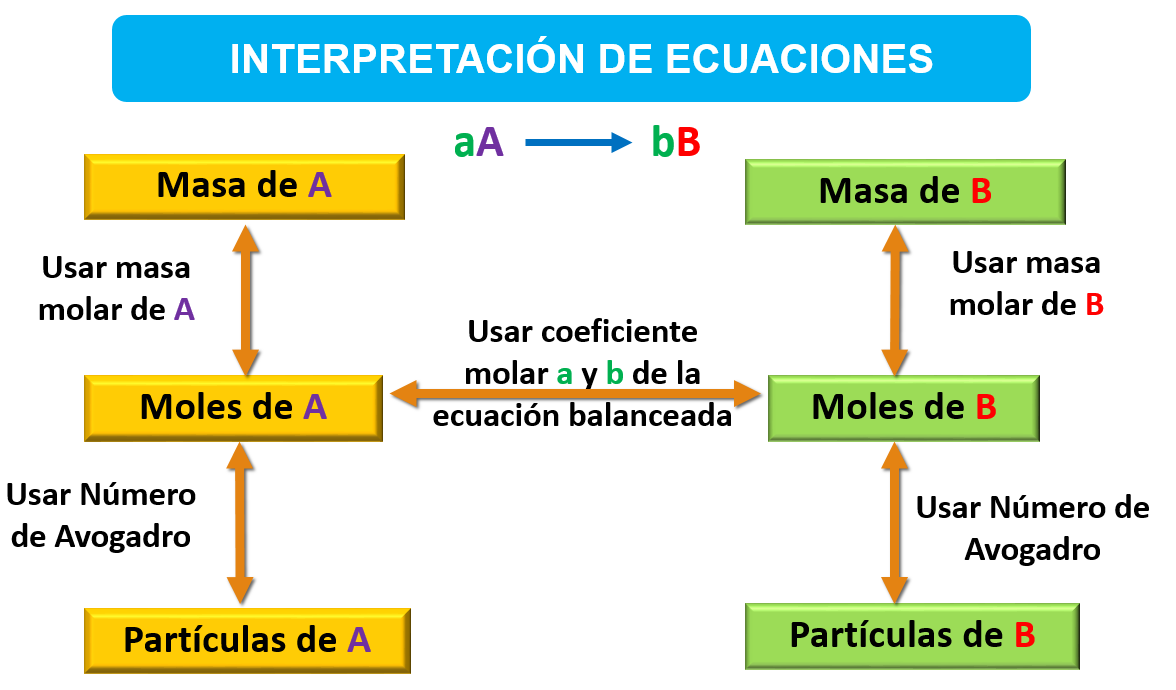
El concepto de mol puede servir para calcular las cantidades relativas de reactivos y productos que intervienen en las reacciones químicas. Los coeficientes de una ecuación balanceada dan los números relativos de moles de reactivos y productos.
Así, para calcular el número de gramos de un producto a partir del número de gramos de un reactivo, primero se convierten gramos de reactivo a moles de reactivo. Luego se usan los coeficientes de la ecuación balanceada para convertir el número de moles de reactivo a número de moles de producto. Por último, se convierten los moles de producto a gramos de producto. La masa molar y el número de Avogadro se emplean como factores de conversión para convertir gramos → moles → átomos.
Bosquejo del procedimiento empleado para interconvertir la masa de una sustancia en gramos y el número de unidades formulares de esa sustancia

Ejemplo: ¿Cuántas moléculas de glucosa hay en 5,23 g de C6H12O6?
Sabiendo la masa molar de la glucosa (180,0 g/mol de C6H12O6) y con el número de Avogadro, se encuentran las moléculas de glucosa:
= 5,23 g C6H12O6 x 1 mol C6H12O6 x 6,02x1023 moléculas de C6H12O6
180,0 g C6H12O6 1 mol C6H12O6
= 1,75 x 1022 moléculas de C6H12O6
INTERPRETACIÓN DE ECUACIONES
Información cuantitativa a partir de ecuaciones balanceadas
Los coeficientes de una ecuación química balanceada se pueden interpretar como los números relativos de moléculas (o unidades formulares) que intervienen en la reacción y también como los números relativos de moles. Las cantidades dadas por los coeficientes de las ecuaciones se denominan cantidades estequiométricamente equivalentes. Estas relaciones estequiométricas pueden servir para obtener factores de conversión que relacionen las cantidades de reactivos y productos en una reacción química.
Por ejemplo, para la reacción del hidrógeno con oxígeno:
el número de moles de H2O que se producen a partir de 1,57 mol de O2 se puede calcular así:
Moles de H2O = 1,57 mol O2 x 2 mol H2O= 3,14 mol H2O
1 mol O2
En el caso de partir de una masa de reactivos, primero se calculan los moles presentes en esa masa a partir de la masa molar, luego se hace una relación estequiométrica a partir de la ecuación balanceada y luego se puede averiguar la masa de la otra sustancia.
Por ejemplo, calculemos la masa de CO2 que se produce al quemar 1,00 g de C4H10.
Según la ecuación:
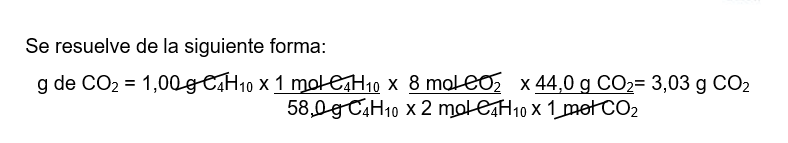
Bosquejo del procedimiento empleado para calcular la fórmula empírica de una sustancia a partir de su composición porcentual.
REACTANTE LÍMITE Y EN EXCESO
En las reacciones químicas cuando uno de los reactivos se agota antes que los demás la reacción se detiene, esto sucederá tan pronto como se consume totalmente cualquiera de los reactivos, y quedan los reactivos en exceso como sobrantes. Al reactivo que se El reactivo que se consume por completo en una reacción se denomina reactivo limitante porque determina, o limita, la cantidad de producto que se forma. Para entender mejor ambos conceptos se puede comparar como cuando se preparan sándwich de queso, empleando una rebanada de queso y dos rebanadas de pan por sándwich. Si tenemos 10 rebanadas de pan y 7 rebanadas de queso, sólo se pueden preparar cinco emparedados antes de que se acabe el pan, y sobrarán dos rebanadas de queso. La cantidad de pan limita el número de sándwich.
Un ejemplo aplicado a una reacción química sería una mezcla de 10 mol H2 y 7 mol
O2, que reaccionan para formar agua:
Dado que 2 mol H2 requieren 1 mol O2, el número de moles de O2 que se necesitan para reaccionar con todo el H2 es
Moles de O2 = 10 mol H2 x 1 mol O2= 5 mol O2
2 mol H2
Puesto que había 7 mol O2 al iniciarse la reacción, habrá 7 mol O2 - 5 mol O2 = 2 mol O2 presentes cuando se haya consumido todo el H2. En el ejemplo, el H2 es el
reactivo limitante, lo que implica que una vez que se haya consumido todo el H2, la reacción se detendrá; el O2 es el reactivo en exceso; todavía queda algo de él cuando la reacción se detiene.
No hay restricciones respecto a las cantidades iniciales de los reactivos en una reacción. Sin embargo, las cantidades de reactivos consumidos y de productos formados están restringidas por la cantidad de reactivo limitante.
Ejemplo 1: el proceso comercial más importante para convertir N2 del aire en compuestos nitrogenados se basa en la reacción de N2 y H2 para formar
amoniaco (NH3): ¿Cuántos moles de NH3 se pueden formar a partir de 3,0 mol de N2 y 6,0 mol de H2? Considerar la siguiente ecuación de la reacción:
Solución: se pide calcular el número de moles de producto, es decir NH3, dadas las cantidades de cada reactivo, N2 y H2, con que se cuenta para una reacción, así que se trata de un problema de reactivo limitante. Suponiendo que un reactivo se consume por completo, se calcula la cantidad del segundo reactivo que se requiere en la reacción. Al comparar la cantidad calculada con la cantidad disponible, se determina cuál reactivo es el limitante.
El número de moles de H2 requeridos para que se consuma totalmente 3,0 mol de N2 es:
Moles de H2 = 3,0 mol N2 x 3 mol H2= 9,0 mol H2
1 mol N2
Sólo se cuenta con 6,0 mol de H2, por lo tanto, se agotaría el H2 antes de que desaparezca todo el N2, así que H2 es el reactivo limitante. El reactivo limitante es el que determina la cantidad de producto que se va a generar en la reacción, Usando la cantidad del reactivo limitante, H2, para calcular la cantidad de NH3 producida:
Moles de NH3 = 6,0 mol H2 x 2 mol NH3= 4,0 mol NH3
3 mol H2
Ejemplo 2: considere la reacción siguiente:
Suponga que una disolución que contiene 3,50 g de Na3PO4 se mezcla con una disolución que contiene 6,40 g de Ba(NO3)2. ¿Cuántos gramos de Ba2(PO4)2 podrán formarse?
Solución: se tiene una reacción química y las cantidades de dos reactivos (3,50 g de Na3PO4 y 6,40 g de Ba(NO3)2). Se pide calcular el número de gramos de Ba3(PO4)2 dadas las cantidades de dos reactivos, así que se trata de un problema de reactivo limitante. Por tanto, primero se identifica el reactivo limitante. Para hacerlo, es preciso calcular el número de moles de cada reactivo y comparar su proporción con la que requiere la ecuación balanceada. Luego se usa la cantidad del reactivo limitante para calcular la masa de Ba3(PO4)2 que se forma. A partir de la ecuación balanceada, tenemos las relaciones estequiométricas siguientes:
2 mol Na3PO4 reaccionan con 3 mol Ba(NO3)2 para producir 1 mol de Ba3(PO4)2
Utilizando la masa molar de cada sustancia, se calcula el número de moles de cada reactivo:
Moles de Na3PO4 = 3,50 g Na3PO4 x 1 mol Na3PO4= 0,0213 mol Na3PO4
164 g Na3PO4
Moles de Ba(NO3)2 = 6,40 g Ba(NO3)2 x 1 mol Ba(NO3)2 = 0,0245 mol Ba(NO3)2
261 g Ba(NO3)2
Estos cálculos muestran que el número de moles de Ba(NO3)2 es un poco mayor que el de Na3PO4. Sin embargo, los coeficientes de la ecuación balanceada indican que la reacción requiere 3 mol Ba(NO3)2 por cada 2 mol Na3PO4. Es decir, se requieren 1,5 veces más moles de Ba(NO3)2 que de Na3PO4. Por tanto, no hay suficiente Ba(NO3)2 para consumir totalmente el Na3PO4. Esto implica que el Ba(NO3)2 es el reactivo limitante. Por tanto, se usa la cantidad de Ba(NO3)2 para calcular la cantidad de producto que se forma:
g de Ba3(PO4)2 = 0,0245 mol Ba(NO3)2 x 1 mol Ba3(PO4)2 x 602 g Ba3(PO4)2 3 mol Ba(NO3)2 x 1 mol Ba3(PO4)2
= 4,92 g Ba3(PO4)2
RENDIMIENTOS TEÓRICO Y REAL
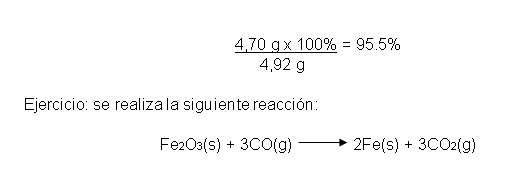
Rendimiento Teórico se llama a la cantidad de producto que se forma cuando reacciona todo el reactivo limitante. El rendimiento real es la cantidad de producto que realmente se obtiene en una reacción. El rendimiento real casi siempre es menor (y nunca puede ser mayor) que el rendimiento teórico. Esto se puede deber a que una parte de los reactivos no reaccione, o que se generen reacciones secundarias. El porcentaje de rendimiento de una reacción relaciona el rendimiento real con el teórico (calculado):
Porcentaje de rendimiento = rendimiento real x 100%
rendimiento teórico
En el experimento descrito en el ejemplo 2 del rendimiento teórico, dónde se hacía una reacción con 3,50 g de Na3PO4 y 6,40 g de Ba(NO3)2, se calculó que se deberían formar 4,92 g de Ba3(PO4)2. Éste es el rendimiento teórico de Ba3(PO4)2 en la reacción. Si resultara que al hacer la reacción en un laboratorio el rendimiento real fue de 4,70 g, el porcentaje de rendimiento sería:
(a) Si se parte de 150 g de Fe2O3 como reactivo limitante, ¿cuál será el rendimiento teórico de Fe? (b) Si el rendimiento real de Fe en la prueba fue de 87,9 g, calcule el porcentaje de rendimiento.
Respuestas: (a) 105 g de Fe; (b) 83,7%
TEMA 6.2.5 PORCENTAJES DE PUREZA EN REACTANTES
Los reactivos usados en el laboratorio tienen cierta cantidad de impurezas. En su mayoría estas impurezas son materia inerte, y aunque en general no reaccionan, es necesario tomar en cuenta la pureza de los reactivos para realizar los cálculos estequiométricos. Cuando se determina la masa del reactivo impuro debe restarse las impurezas para contemplar solo la cantidad de efectiva de reactivo puro que va a reaccionar en los cálculos de estequiometría. Se denomina pureza al porcentaje efectivo de reactivo puro en la masa total.
% Pureza = masa de materia pura x 100%
masa de materia impura
Ejemplo ¿Cuál es el porcentaje de pureza de un C2H2 comercial si al poner a reaccionar 1 g de C2H2, con un exceso de oxígeno, se obtienen 0,58 g de H2O?
Para resolver este problema y encontrar la pureza de C2H2 es necesario saber la cantidad de materia pura de C2H2 (reactivo limitante) que reaccionó (puesto que el oxígeno está en exceso), para ello utilizamos una relación estequiométrica a partir de la cantidad de agua producida, asumiendo que el porcentaje de rendimiento fue del 100%. (Recordar que las relaciones estequiométricas se dan en moles, es necesario convertir las masas a moles)
gramos de C2H2 puros = 0,58 g H2O x 1 mol H2O x 2 mol C2H2 x 26 g C2H2
18 g H2O 2 mol H2O 1 mol C2H2
gramos de C2H2 puros = 0,84 g
Este valor corresponde a la cantidad de C2H2 que realmente reaccionó. Como la pureza debe darse como un porcentaje, hay que calcularlo.
% Pureza = masa de materia pura x 100% = 0,84 g C2H2 puro x 100%
masa de materia impura 1,0 g C2H2 impuro
= 84% de pureza de C2H2