FUERZAS INTERMOLECULARES
Las fuerzas intermoleculares son las fuerzas de atracción existentes entre moléculas con enlace covalente. Estas fuerzas están presentes en las sustancias covalentes cuando se encuentran en estado sólido o líquido. Existen tres tipos de fuerzas de atracción entre moléculas neutras: fuerzas dipolo permanente-dipolo permanente, fuerzas de puente de hidrógeno y fuerzas dipolo inducido-dipolo inducido.
DIPOLO PERMANENTE-DIPOLO PERMANENTE
Se presentan entre moléculas covalentes polares. Se deben a la interacción entre los dipolos que constituyen las moléculas. Las moléculas polares se atraen entre sí debido a las atracciones entre sus dipolos. Para moléculas con masas y tamaños aproximadamente iguales, la intensidad de las atracciones intermoleculares aumenta al incrementarse la polaridad.
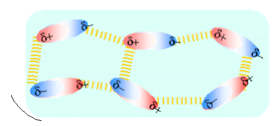
PUENTES DE HIDRÓGENO
Podría considerarse como un enlace dipolo-dipolo, pero de gran intensidad. Se presenta entre moléculas que tienen el hidrógeno unido a un elemento muy electronegativo: F, N, O
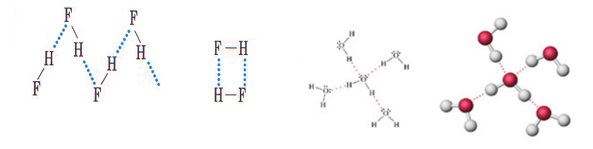
En la molécula de agua se forman dos polos, O polo negativo y H polo positivo, el átomo de H forma una unión electrostática con el átomo de O de una molécula vecina. También presentan este tipo de enlace otras moléculas como HF y NH3.
DIPOLO INDUCIDO-DIPOLO INDUCIDO
Se presentan entre moléculas covalentes apolares. Se deben a la aparición de dipolos instantáneos que se crean con el movimiento de los electrones.
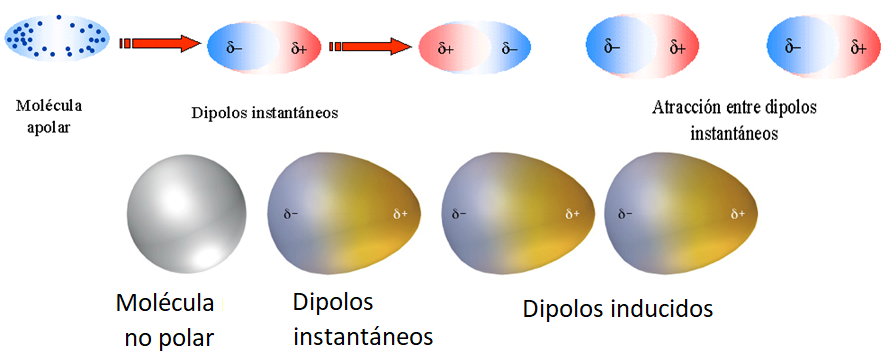
Polarizabilidad: La facilidad con que la distribución de carga de una molécula puede distorsionarse por la acción de un campo eléctrico externo. Cuanto mayor es la polarizabilidad de una molécula, más fácilmente puede distorsionarse su nube de electrones para crear un dipolo momentáneo. Por tanto, las moléculas más polarizables tienen fuerzas de dispersión más intensas. Las moléculas más grandes tienden a tener una polarizabilidad mayor porque tienen un mayor número de electrones y los electrones están más lejos del núcleo. La intensidad de las fuerzas de dispersión tiende a aumentar al incrementarse el tamaño molecular.
DIPOLO PERMANENTE-DIPOLO INDUCIDO
Al acercarse un dipolo a una molécula no polar genera sobre ésta una distorsión de la nube de electrones, originando un dipolo transitorio.