NOMBRES Y FÓRMULAS DE COMPUESTOS INORGÁNICOS
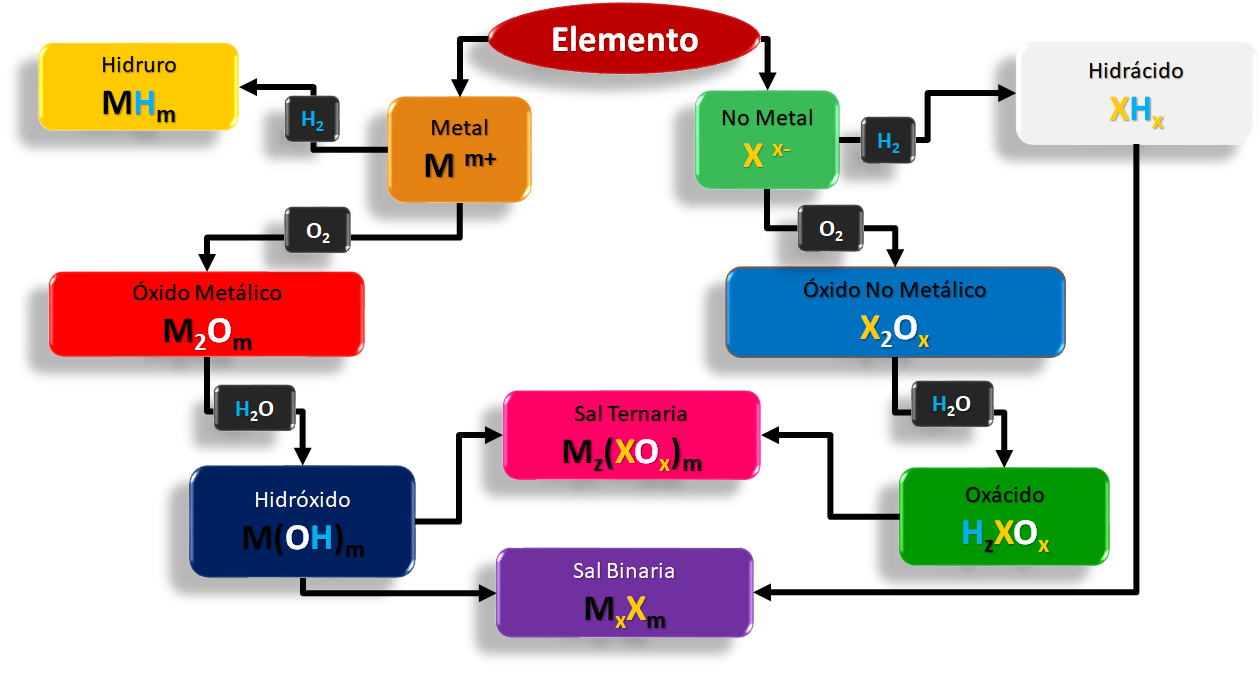
En la naturaleza hay sustancias que se descomponen químicamente en otras más simples, tal como el cloruro de sodio (sal común) que se descompone en sodio y cloro. Algunas no se descomponen en otras más simples, tal como el aluminio. Las primeras reciben el nombre de compuestos y las segundas reciben el nombre de elementos. Estos últimos se agrupan en metales o no metales.
Para nombrar los correctamente los compuestos inorgánicos es necesario conocer el nombre, fórmula y números de oxidación de los metales y los no metales, en el cuadro 5 y 6 encontrará un listado de los mismos.
Cuadro 5. Nombres, símbolo y números de oxidación de algunos metales
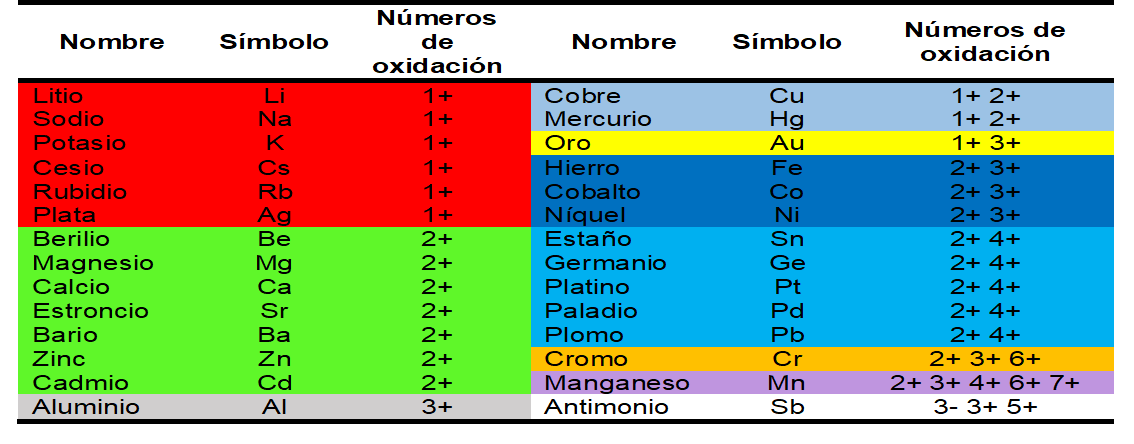
Cuadro 6. Nombres, símbolo y números de oxidación de algunos no metales

Para escribir la fórmula correcta de un compuesto químico se siguen ciertas reglas
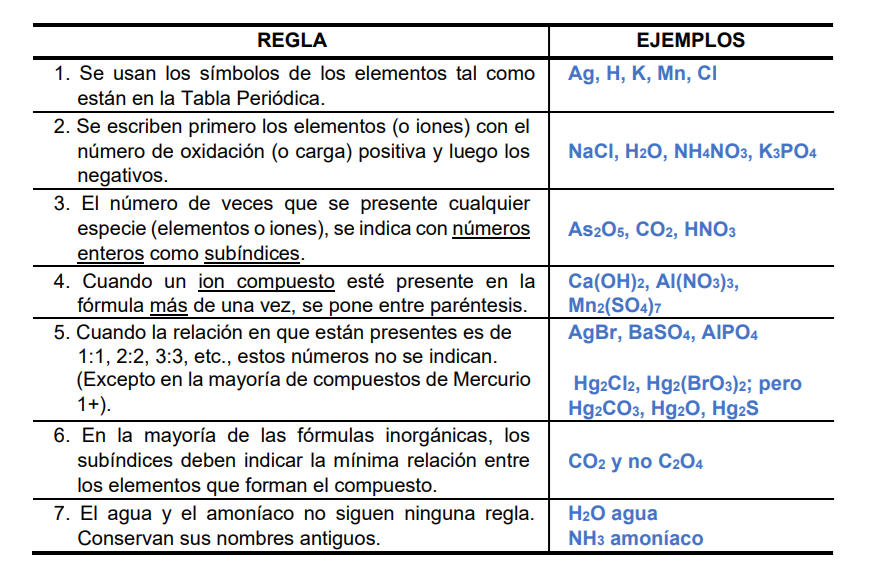
El nombre correcto de un compuesto -a partir de su fórmula- debe indicar los elementos que lo forman y las proporciones en que se encuentra.
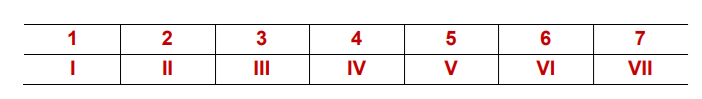
Cuando hay que indicar el número de oxidación en el nombre, se usan los números romanos, en mayúscula. Del 1 al 7 se indican en el cuadro.
Existen varios sistemas para dar el nombre; entre ellos está el SISTEMÁTICO y el STOCK –recomendado, por la Unión Internacional de Química Pura y Aplicada- y el COMÚN ya casi en desuso. Cada sistema contiene reglas, aquí se irán presentando las del sistema Stock.
ÓXIDOS DE ELEMENTOS METÁLICOS


ÓXIDOS DE ELEMENTOS NO METÁLICOS:


HIDRÓXIDOS (BASES)

HIDRUROS


COMPUESTOS IÓNICOS
Los compuestos iónicos por lo regular consisten en combinaciones químicas de metales y no metales. Los metales forman los iones positivos, y los no metales, los negativos.


Resumen del procedimiento para designar aniones. La raíz del nombre (como “clor” en el caso del cloro) va en el espacio en blanco.
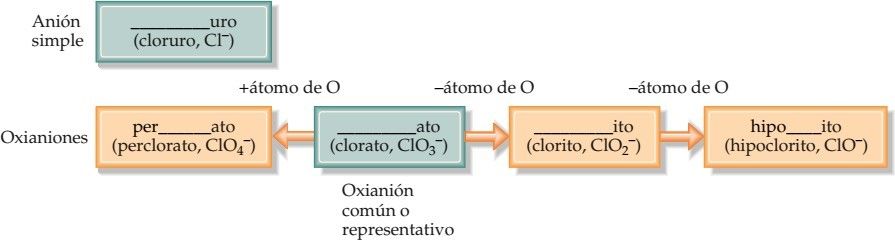
(c) Los aniones que se obtienen agregando H a un oxianión se designan agregando como prefijo la palabra hidrógeno o dihidrógeno, según resulte apropiado:

Algunos radicales compuestos
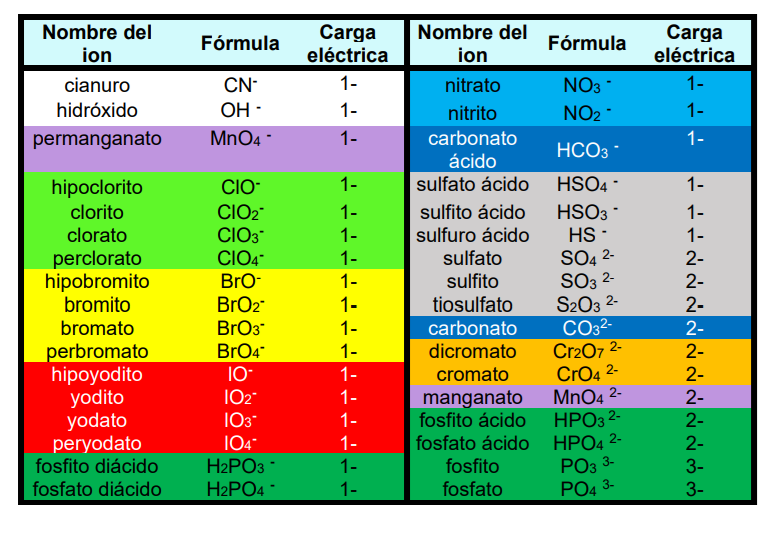
SALES

ÁCIDOS


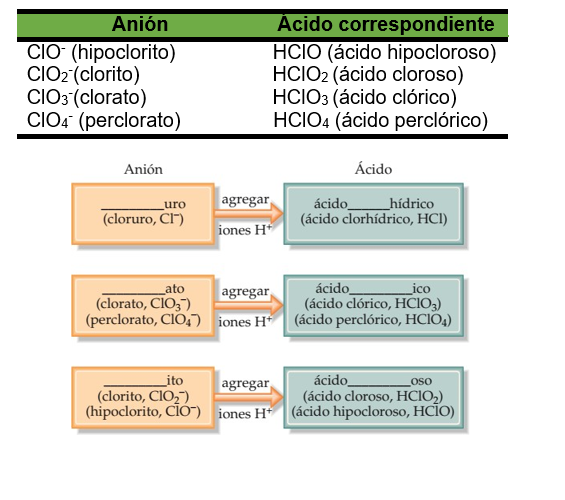
SALES ÁCIDAS

SALES CUATERNARIAS DE AMONIO

NOMBRES Y FÓRMULAS DE COMPUESTOS MOLECULARES BINARIOS

