Número Cuánticos
La solución de la ecuación de Schrödinger para el átomo de hidrógeno produce un conjunto de funciones matemáticas, llamadas funciones de onda, las cuales describen al electrón en el átomo y sus energías correspondientes, conocidas como orbitales. Cada orbital describe una distribución específica de densidad electrónica en el espacio, dada por su densidad de probabilidad
- Número cuántico principal, n: puede tener valores enteros positivos de 1,2,3… Cuando n aumenta, el orbital se hace más grande y el electrón pasa más tiempo lejos del núcleo. Un aumento de n significa que el electrón tiene mayor energía y que está menos unido al núcleo.
- Número cuántico azimutal, ɭ: puede tener valores enteros de 0 a n - 1 para cada valor de n. Este número cuántico define la forma del orbital. El valor de ɭ para un orbital dado generalmente se designa con las letras s, p, d, f, g, h que corresponden a valores de ɭ de 0, 1, 2, 3, 4, 5, 6 respectivamente.
- Número cuántico magnético, mɭ: puede tener valores enteros etre ɭ y - ɭ, lo que incluye cero. Este número cuántico describe la orientación del orbital en el espacio.
El conjunto de orbitales que poseen el mismo valor de n se denomina capa electrónica. Por ejemplo, los orbitales que tienen n=3 están en la tercera capa. Además, el conjunto de orbitales que tienen los mismos valores de n y ɭ se llama subcapa. Cada subcapa se designa con un número (el valor de n) y una letra (s, p, d o f, que corresponde al valor de ɭ). Por ejemplo, los orbitales que tienen n = 3 y ɭ = 2 se denominan orbitales 3d y están en la subcapa 3d.
La capa con número cuántico principal n consiste en exactamente n subcapas. Cada subcapa corresponde a un valor permitido distinto de ɭ, desde 0 hasta n = 1. Por tanto, la primera capa (n = 1), consiste en una sola subcapa, la 1s (ɭ = 0); la segunda capa (n = 2), consiste en dos subcapas, la 2s (ɭ = 0) y la 2p (ɭ = 1); la tercera capa consiste de tres subcapas, 3s, 3p y 3d, etcétera.
Cada subcapa consiste en un número específico de orbitales. Cada orbital corresponde a un valor permitido de mɭ distinto. Para un valor dado de ɭ, hay 2 ɭ = 1 valores permitidos de mɭ, que van de - ɭ hasta - ɭ. Así, cada subcapa s (ɭ = 0) consiste en un orbital; cada subcapa p (ɭ = 1) consiste en tres orbitales; cada subcapa d (ɭ = 2) consiste en cinco orbitales, etcétera.
Cuando un electrón está en el orbital de energía más baja (el orbital 1s), decimos que el átomo de hidrógeno está en su estado basal. Si el electrón está en cualquier otro orbital, el átomo está en un estado excitado. A temperaturas ordinarias, prácticamente todos los átomos de hidrógeno están en sus estados basales. El electrón se puede excitar a un orbital de más alta energía por absorción de un fotón con la energía apropiada.
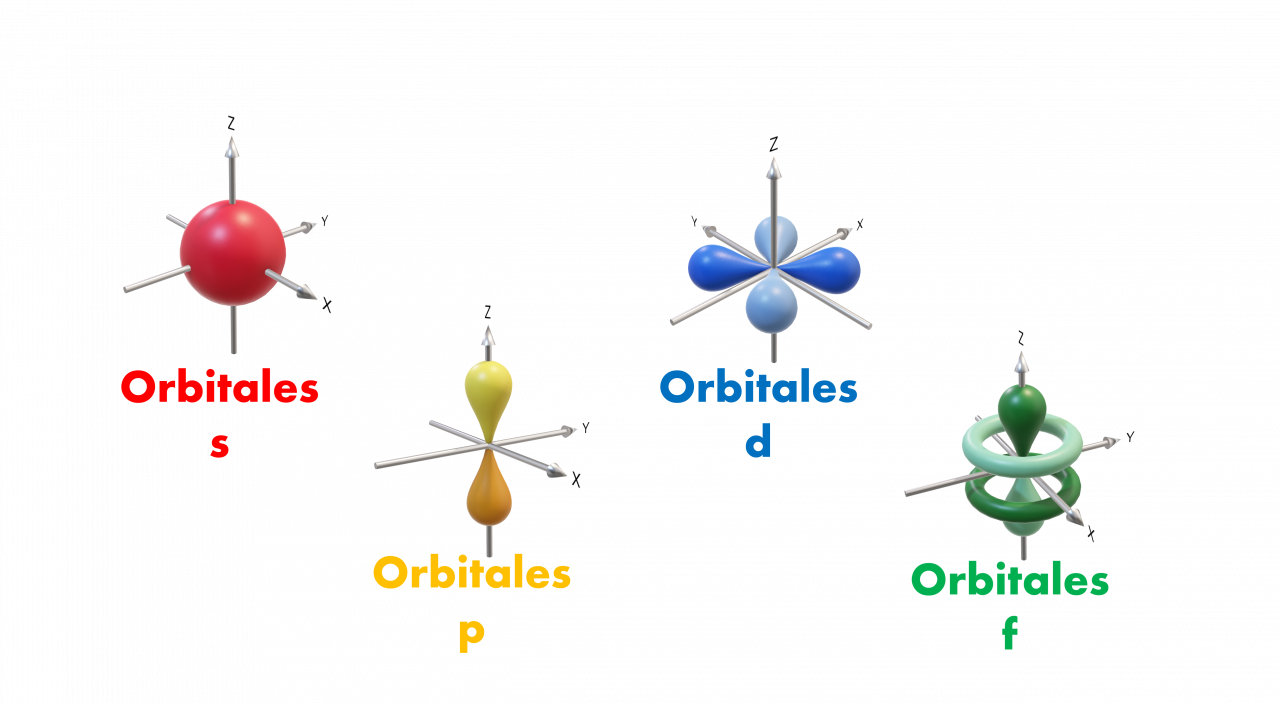
Un método que se utiliza ampliamente para representar orbitales es dibujar una superficie de frontera que encierra una porción sustancial, cerca del 90%, de la densidad electrónica total del orbital.
Las características más importantes de los orbitales son su tamaño relativo y su forma, las que se describen satisfactoriamente con las representaciones de contorno.
El orbital de más baja energía, el 1s, es esférico, todos los orbitales s tienen simetría esférica.
En el orbital p hay tres orbitales con la misma energía pero con diferente orientación espacial y la densidad electrónica se concentra en dos regiones a los lados del núcleo, separadas por un nodo en el núcleo; este orbital con forma de mancuerna tiene dos lóbulos.
En los orbitales d hay cinco orbitales. Los diferentes orbitales d de una capa dada tienen distintas formas y orientaciones en el espacio. Cuatro de los orbitales d tienen forma de “trébol de cuatro hojas”, y todos yacen primordialmente en un plano.
Cuando n es 4 o mayor, hay siete orbitales f equivalentes Las formas de los orbitales f son aún más complicadas que las de los orbitales d.
Los orbitales que tienen la misma energía se describen como degenerados.
- Número cuántico magnético de espín, ms: los electrones tienen una propiedad intrínseca, llamada espín electrónico. Al parecer, el electrón se comporta como si fuera una esfera diminuta que gira (spin, en inglés) sobre su propio eje. Sólo se permiten dos valores para ms: +1/2 y -1/2 que inicialmente se interpretaron como indicativos de las dos direcciones opuestas en las que el electrón puede girar.
El principio de exclusión de Pauli: en un átomo no puede haber dos electrones que tengan el mismo conjunto de cuatro números cuánticos, n, ɭ, mɭ y ms. Para un orbital dado los valores de n, ɭ y mɭ están fijos. Por tanto, si queremos colocar más de un electrón en un orbital y satisfacer el principio de exclusión de Pauli, nuestra única opción es asignar diferentes valores de ms a los electrones. Dado que sólo hay dos de estos valores, concluimos que un orbital puede contener un máximo de dos electrones, los cuales deben tener espines opuestos. Esta restricción nos permite hacer referencia a los electrones del átomo, dando sus números cuánticos y por tanto definiendo la región del espacio en la que es más probable encontrar cada electrón.
CONFIGURACIONES ELECTRÓNICAS
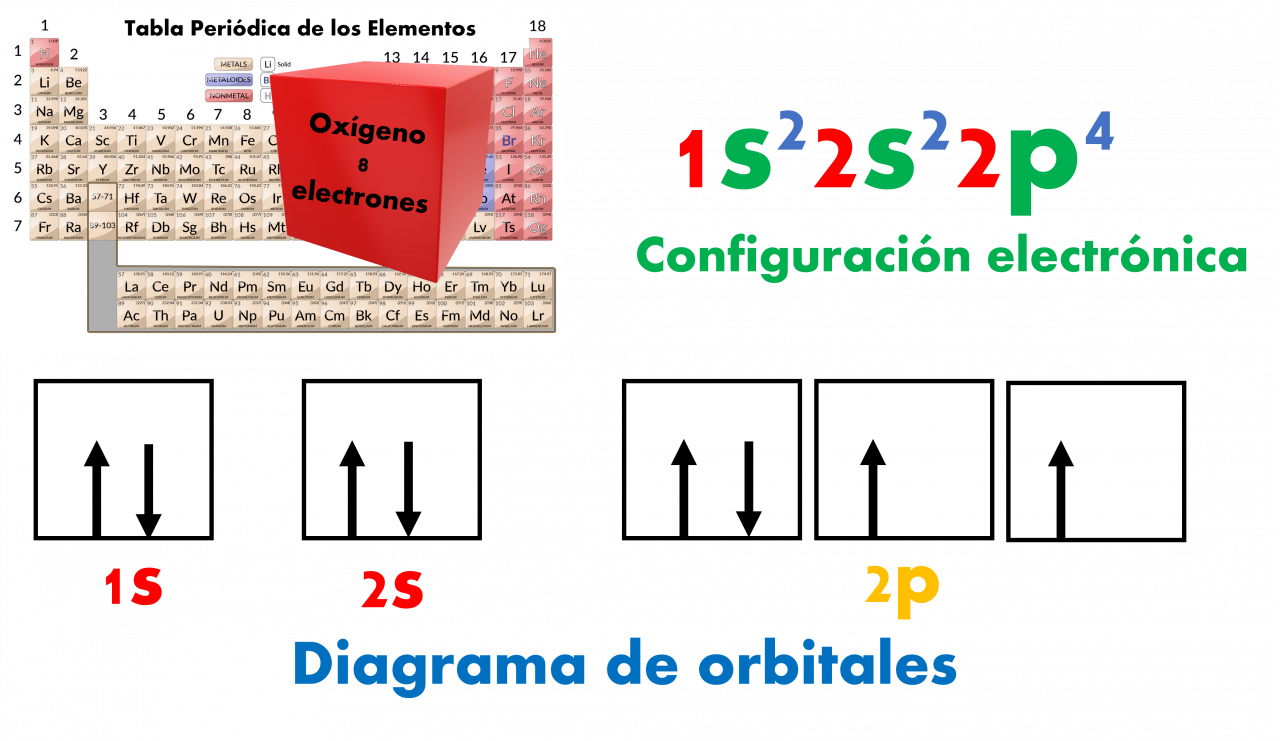
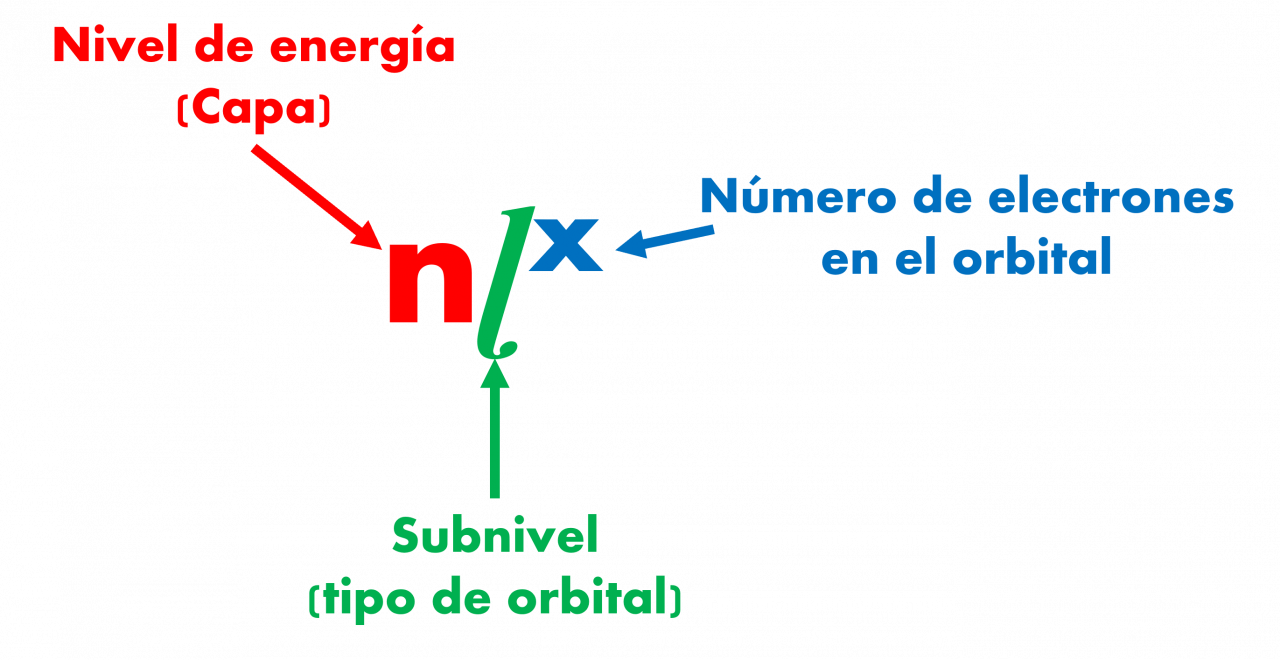
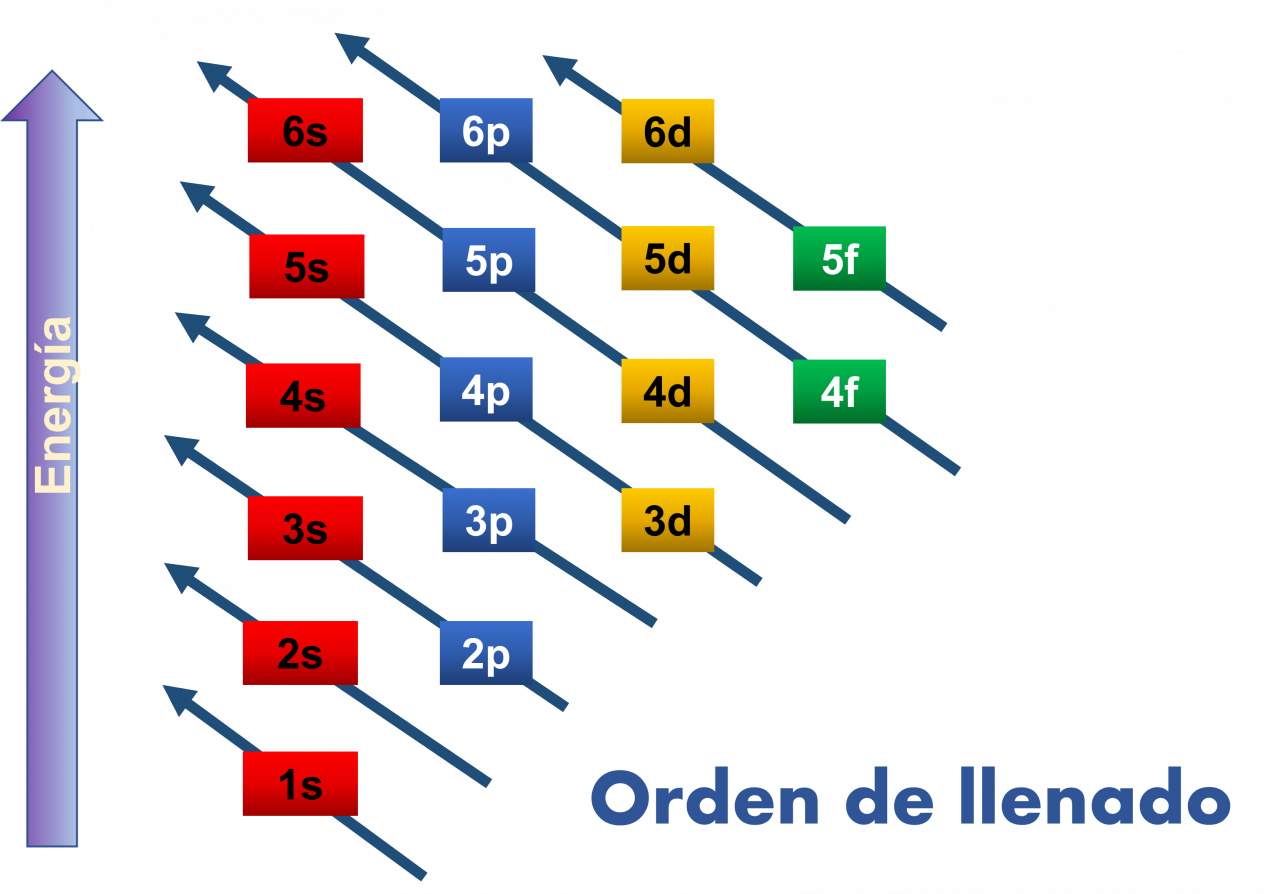
La forma en que los electrones se distribuyen entre los diferentes orbitales de un átomo es su configuración electrónica (sistema nɭx). La configuración electrónica más estable, o basal, de un átomo es aquella en la que los electrones están en los estados de energía más bajos posibles. Los orbitales se llenan en orden de energía creciente, con un máximo de dos electrones por orbital.
Ejemplo: se muestra la configuración electrónica del boro que tiene 5 electrones:
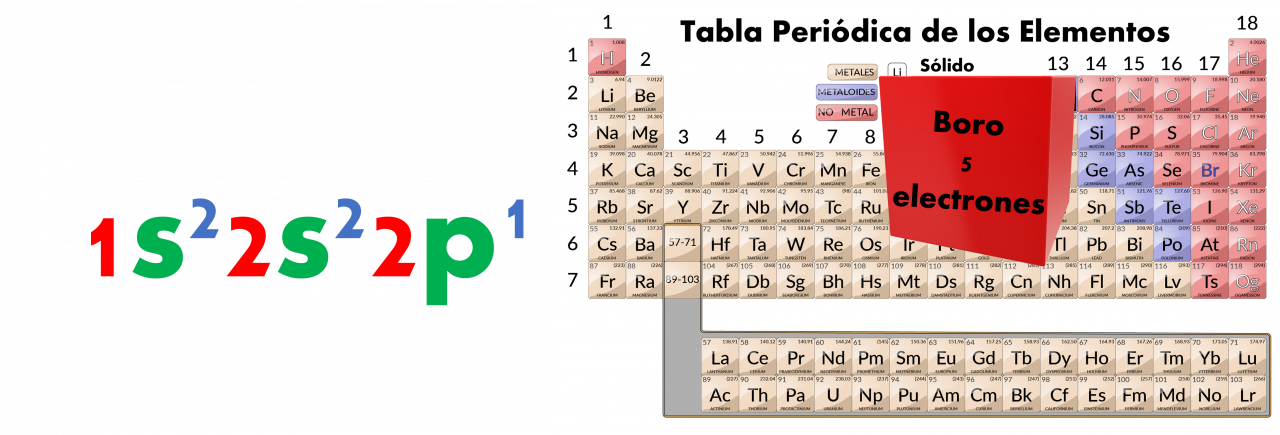
DIAGRAMA DE ORBITALES
Es la representación gráfica de la configuración electrónica, donde cada orbital se representa con un cuadrito, y cada electrón, con una media flecha. Cuando dos electrones con espines opuestos ocupan el mismo orbital, se dice que están apareados.
Regla de Hund: dice que en el caso de orbitales degenerados, se alcanza la menor energía cuando el número de electrones que tienen el mismo espín es el más alto posible. Esto implica que los electrones ocuparán orbitales individualmente hasta donde sea posible, con el mismo número cuántico magnético de espín. Decimos que los electrones así acomodados tienen espines paralelos. Los electrones se repelen mutuamente. Al ocupar diferentes orbitales, los electrones mantienen la distancia máxima entre sí, y las repulsiones electrón-electrón son mínimas.
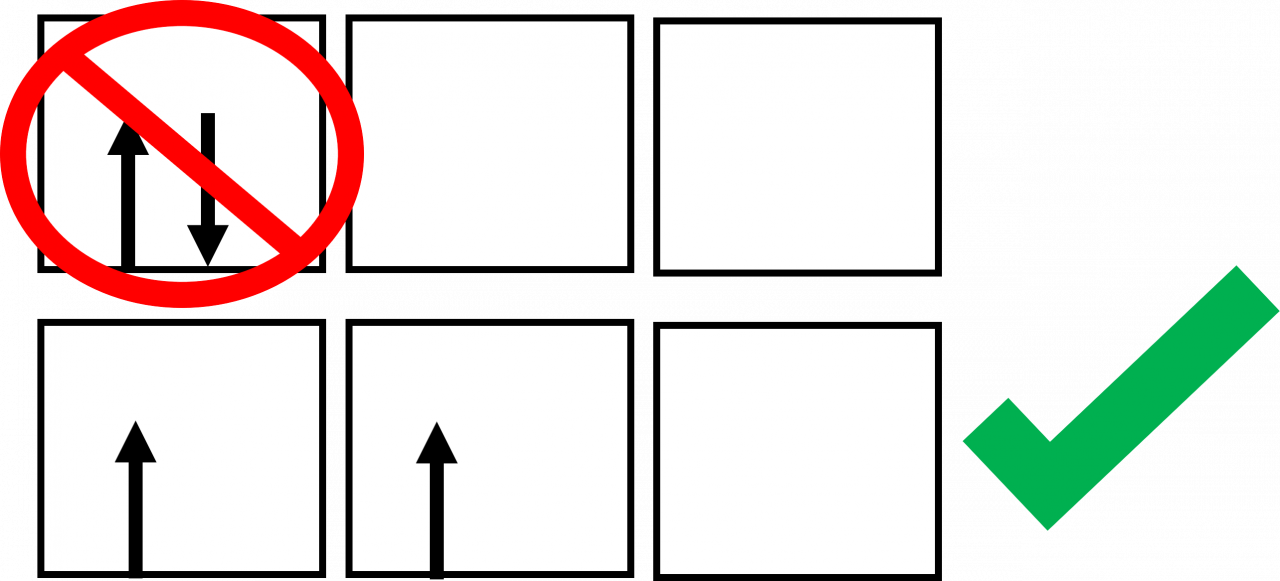
Los electrones que se dan después del centro de gas noble se denominan electrones de capa externa o electrones de valencia.
El principio de construcción: (el principio de Aufbau) establece que cuando los protones se incorporan al núcleo de uno en uno para construir los elementos, los electrones se suman de la misma forma a los orbitales atómicos.
Ejemplo de diagrama de orbitales para el oxígeno: