Curvas de calentamiento
¿Qué sucede al calentar una muestra de hielo que está a -25ºC y 1 atm de presión?
Al adicionar calor la temperatura del hielo irá aumentando. La muestra estará congelada mientras la temperatura esté por debajo de 0ºC y empezará a derretirse cuando la temperatura llegue a 0ºC. Como la fusión es un proceso endotérmico, el calor agregado a 0ºC se utilizará para convertir hielo en agua, y la temperatura será constante hasta que se haya fundido todo el hielo. Al estar en el punto de fusión, cualquier calor añadido provocará que la temperatura del agua líquida aumente.
Una curva de calentamiento es una gráfica de la temperatura del sistema contra la cantidad de calor agregada. En la figura 7.9 se muestra una curva de calentamiento para convertir hielo a -25ºC en vapor de agua a 125ºC a una presión constante de 1 atm.
Figura 7.9. Curva de calentamiento para la transformación de 1.00 mol de agua de -25ºC a 125ºC a una presión constante de 1 atm. Las líneas azules muestran el calentamiento de una fase desde una temperatura más baja a una más alta. Las líneas rojas muestran la conversión de una fase en otra a temperatura constante.
El segmento de línea AB representa el calentamiento del hielo de -25ºC a 0ºC, la conversión de hielo a 0ºC en agua a 0ºC (punto de fusión) es el segmento horizontal BC. El segmento CD es el calentamiento para aumentar la temperatura del agua hasta llegar a 100ºC. En el segmento DE se representa el calor usado para convertir agua en vapor a una temperatura constante de 100ºC (punto de ebullición). El último segmento EF es cuando toda el agua se ha convertido en vapor, calentando hasta su temperatura final de 125ºC.
Se puede calcular el calor del sistema involucrado en cada uno de los segmentos de la curva de calentamiento. En los segmentos AB, CD y EF hay una sola fase de una temperatura a otra. La cantidad de calor necesaria para elevar la temperatura de la sustancia se encuentra al multiplicar el calor específico (cesp), la masa y el cambio de temperatura. Cuanto mayor es el calor específico de una sustancia, más calor hay que agregar para lograr un aumento de temperatura dado.
q = masa x cesp x ΔT
En los segmentos BC y DE se está convirtiendo una fase en otra a temperatura constante. La temperatura permanece constante durante estos cambios de fase porque la energía agregada se utiliza para vencer las fuerzas de atracción entre las moléculas. En el caso del segmento BC, el cambio de entalpía puede calcularse a partir de ΔHfusión, mientras que para el segmento DE se usa el ΔHebullición. Cuando se multiplica por su masa se obtiene el calor involucrado en el proceso.
q = ΔH x masa
Una vez que se tiene el calor involucrado en cada proceso, se suman para obtener el calor involucrado en el calentamiento del sistema.
qtotal = qAB + qBC + qCD+ qDE + qEF
Para un proceso de enfriamiento se procede de la misma manera, solo se debe tener cuidado que la curva de enfriamiento irá en sentido contrario a la de calentamiento y probablemente los signos del calor se inviertan.
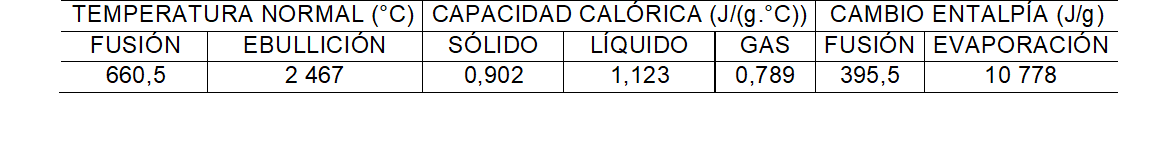
Ejercicio: Calcular el calor involucrado para la conversión de 18,0 g de hielo a -25ºC en vapor de agua a 125ºC, a una presión constante de 1 atm. Los calores específicos del hielo, agua y vapor de agua son 2,09 J/(g K), 4,18 J/(g K) y 1,84 J/(g K), respectivamente. Para el H2O, ΔHfusión = 6,01 kJ/mol, y ΔHebullición = 40,67 kJ/mol. Masa molar del agua = 18 g/mol.
Solución
Se calcula el cambio de entalpía para cada segmento y luego se suman para obtener el calor involucrado.
Para el segmento AB el calentamiento de -25°C a 0°C, se agrega suficiente calor al hielo para aumentar su temperatura 25ºC (ΔT= 0°C - (-25°C) = 25°C = 25 K, recordar que en cambio de temperatura 1°C equivale a 1 K) así para calcular el calor durante este proceso:
qAB = masa x cesp x ΔT
qAB = 18,0 g x 2,09 J/(g K) x 25 K = 940 J = 0,94 kJ
Para el segmento BC en el hielo se transforma en agua a 0ºC (punto de fusión), se usa la entalpía molar de fusión multiplicada por los moles de sustancia (moles = masa / masa molar):
qBC = mol x ΔHfusión
qBC = 18,0 g x 1 mol x 6,01 kJ/mol = 6,01 kJ
18 g
El calor involucrado para los segmentos CD, DE y EF se pueden calcular de forma similar:
qCD = masa x cesp x ΔT
qCD = 18,0 g x 4,18 J/(g K) x 100 K = 7520 J = 7,52 kJ
qDE = mol x ΔHebullición
qDE = 18,0 g x 1 mol x 40,67 kJ/mol = 40,67 kJ
18 g
qDE = masa x cesp x ΔT
qCD = 18,0 g x 1,84 J/(g K) x 25 K = 830 J = 0,83 kJ
El calor total es la suma de los cambios en los pasos individuales:
qtotal = qAB + qBC + qCD+ qDE + qEF = (0,94 + 6,01 + 7,52 + 40,67 +0,83) kJ = 55,97 kJ
Ejercicio: entre los metales, el aluminio ocupa el segundo lugar, después del hierro, en cuanto a uso comercial. ¿Cuánta energía como calor hay involucrada en llevar a 2500°C, una tonelada de aluminio, si inicialmente se encuentra a 500°C?
Solución: Puede emplearse alguno de los dos esquemas siguientes, para visualizar el número de cálculos que hay que hacer.
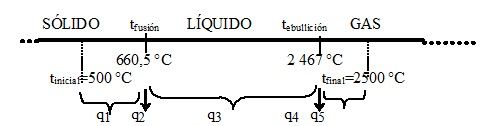
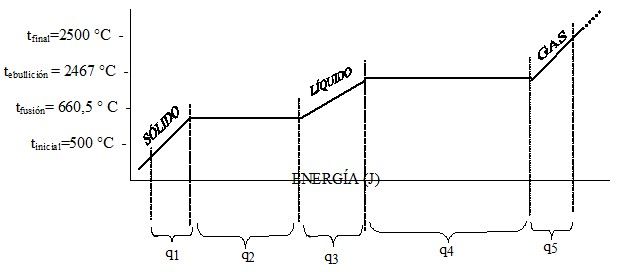
qtotal = q1 + q2 + q3 + q4 + q5
Calentar el sólido
q1 = m x Cm S x ΔT = 1 ton Al x 1x106 g Al x 0,902 J/(g °C) x (660,5 – 500)°C
1 tonAl
q1 = 1,45x108 J
Fundir el sólido q2 = m x ΔHfusión = 106 g Al x 396 J/g = 3,96x108 J
Calentar el líquido
q3 = m x Cm l x ΔT = 106 g Al x 1,123 J/(g °C) x (2467 – 660,5)°C = 2,03x109 J
Evaporar el líquido q4 = m x ΔHevaporación = 106 g Al x 10 778 J/g = 1,08x1010 J
Calentar el gas
q5 = m x Cm g x ΔT = 106 g Al x 0,789 J/(g °C) x (2500 - 2467) °C = 2,6x107 J
qtotal = q1 + q2 + q3 + q4 + q5
qtotal = 1,45x108 J + 3,96x108 J + 2,03x109 J + 1,08x1010 J + 2,6x107 J = 1,34x1010 J
(Nota: todos los q son positivos pues es un calentamiento. Si fuera enfriamiento, todos los q son negativos)