CARGA NUCLEAR, EFECTO DE APANTALLAMIENTO Y CARGA NUCLEAR EFECTIVA.
Ley de Coulomb: “la fuerza de interacción entre dos cargas eléctricas depende de las magnitudes de las cargas y la distancia entre ellas”
Para entender las propiedades de los átomos, se debe conocer no sólo las configuraciones electrónicas, sino también la fuerza de la atracción entre los electrones exteriores y el núcleo. La ley de la atracción de Coulomb, la fuerza de atracción entre un electrón y un núcleo depende de la magnitud de la carga nuclear neta que actúa sobre el electrón, y la distancia promedio entre el núcleo y el electrón. La fuerza de atracción aumenta conforme la carga nuclear se incrementa, y disminuye conforme el electrón se aleja del núcleo. En un átomo poli-electrónico, cada electrón es simultáneamente atraído hacia el núcleo y repelido por demás electrones.
Carga Nuclear Efectiva (Zef): campo eléctrico neto que experimenta un electrón como si proviniera de una sola carga positiva ubicada en el núcleo.
Efecto de pantalla (S): los electrones internos protegen o provocan parcialmente un efecto de pantalla sobre los electrones externos. Los electrones internos son más efectivos para apantallar un electrón de valencia del núcleo (ver figura 1.1). Este efecto se mide por medio de una constante de pantalla (S) que se le resta al valor de carga real para obtener la carga nuclear efectiva. El valor de S generalmente es un número cercano al número de electrones internos en un átomo. Los electrones en la misma capa de valencia no se apantallan entre sí de forma muy efectiva.
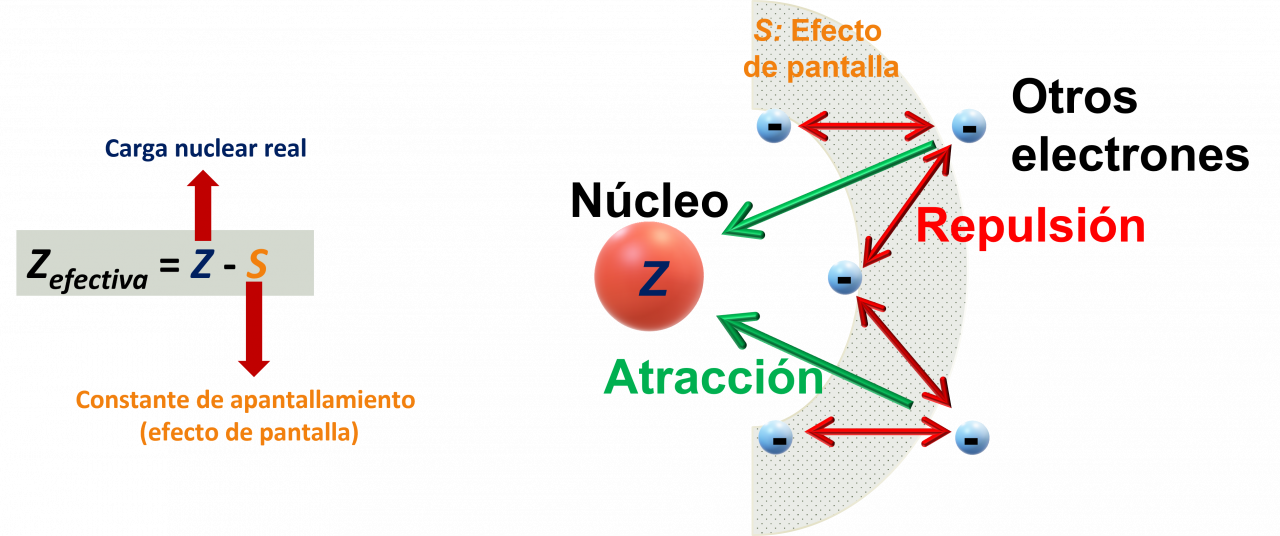
Figura 1.1. Representación del efecto de pantalla.
La carga nuclear efectiva (Zef) aumenta al moverse a través de cualquier periodo de la tabla. Al bajar por una columna, Zef experimentada por los electrones de valencia se reduce más de lo que se reduce a través de un periodo.
PROPIEDADES PERIÓDICAS: RADIO ATÓMICO E IÓNICO, ENERGÍA DE IONIZACIÓN, AFINIDAD ELECTRÓNICA, ELECTRONEGATIVIDAD Y NÚMERO DE OXIDACIÓN.
En 1869, Dmitri Mendeleev en Rusia y Lothar Meyer en Alemania publicaron que las propiedades químicas y físicas similares ocurren periódicamente, si los elementos se acomodan en orden de peso atómico creciente. Los elementos de la misma columna de la tabla periódica tienen la misma cantidad de electrones en sus orbitales de valencia. Esta similitud da origen a las similitudes entre los elementos del mismo grupo. Las diferencias entre los elementos del mismo grupo se deben a que sus orbitales de valencia están en capas distintas.
Muchas propiedades de los átomos se deben a la distancia media entre los electrones externos y el núcleo y a la carga nuclear efectiva (Zef) que experimentan esos electrones. Los electrones internos apantallan de forma muy eficaz a los electrones externos respecto a la carga del núcleo, mientras que los electrones de la misma capa casi no se apantallan entre ellos. Estas propiedades se conocen como propiedades periódicas, como el radio atómico, el radio iónico que relacionan el tamaño, mientras otras relacionan la energía como la energía de ionización, la afinidad electrónica y la electronegatividad. 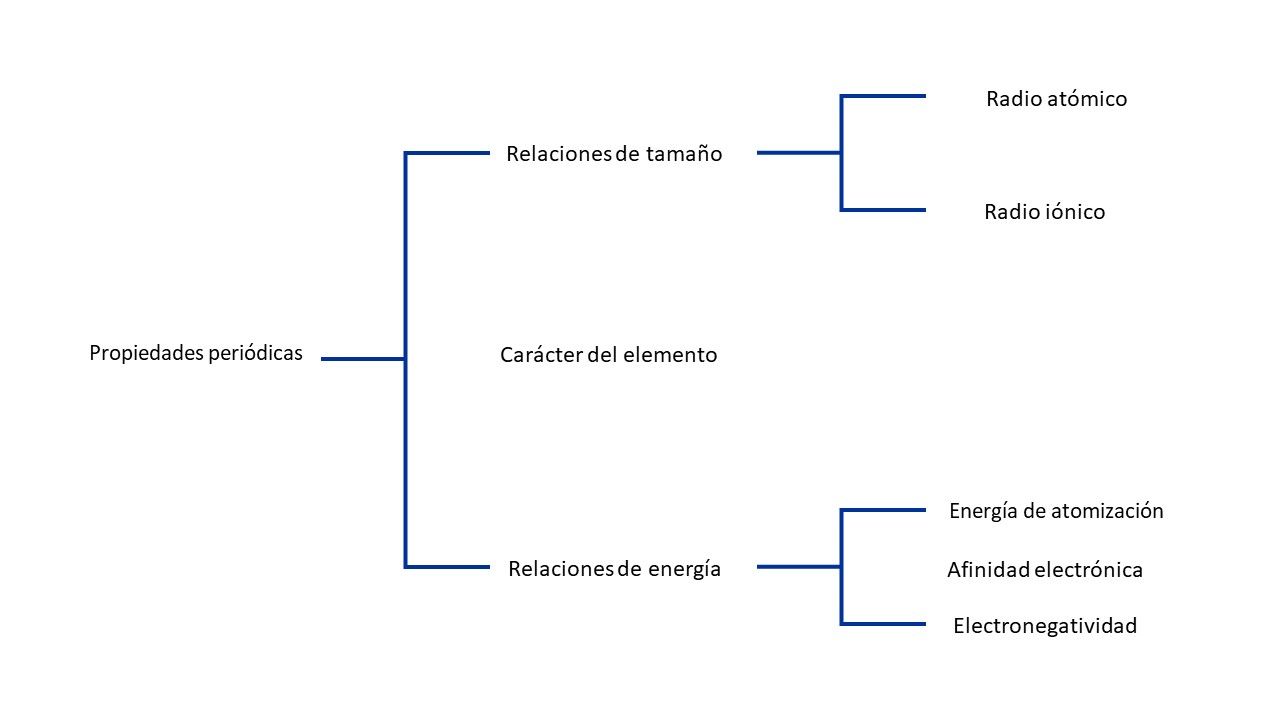
TENDENCIAS PERIÓDICAS EN EL CARÁCTER METÁLICO
La tendencia de un elemento a exhibir las propiedades de los metales, llamada carácter metálico, aumenta conforme se desciende por una columna y disminuye conforme se avanza de izquierda a derecha por una fila. Los metales tienen un lustre característico, y son buenos conductores del calor y la electricidad. Cuando los metales reaccionan con no metales, los átomos metálicos se oxidan a cationes y generalmente se forman sustancias iónicas. Casi todos los óxidos metálicos son básicos; reaccionan con ácidos para formar sales y agua. Los no metales carecen de lustre metálico y son malos conductores del calor y la electricidad. Varios de ellos son gases a temperatura ambiente. Los compuestos formados en su totalidad por no metales generalmente son moleculares. Los no metales por lo regular forman aniones en sus reacciones con metales. Los óxidos no metálicos son ácidos; reaccionan con bases para formar sales y agua.
RADIO ATÓMICO
Es el promedio de la mitad de la distancia entre dos núcleos de átomos iguales. A continuación se muestra una representación esquemática del radio atómico. En general al aumentar el número atómico aumenta el radio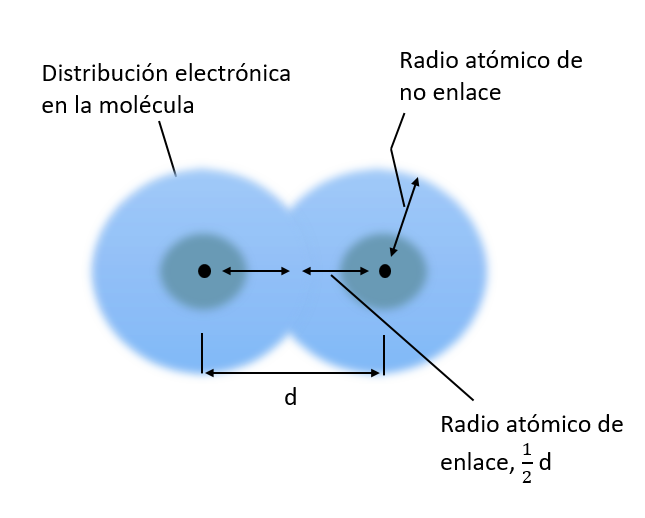
RADIO IÓNICO
Los tamaños de los iones se basan en las distancias entre iones en los compuestos iónicos. Al igual que el tamaño de un átomo, el tamaño de un ion depende de su carga nuclear, del número de electrones que posee y de los orbitales en los que residen los electrones de capa externa. La formación de un catión desocupa los orbitales más extendidos en el espacio y también reduce las repulsiones electrón-electrón totales. El resultado es que los cationes son más pequeños que sus átomos progenitores. Lo contrario sucede con los iones negativos (aniones). Cuando se añaden electrones a un átomo neutro para formar un anión, el aumento en las repulsiones electrón-electrón hace que los electrones se extiendan más en el espacio. Por tanto, los aniones son más grandes que sus átomos progenitores. En iones de la misma carga, el tamaño aumenta al bajar por un grupo de la tabla periódica. Al aumentar el número cuántico principal del orbital ocupado más exterior de un ion, aumenta el tamaño del ion. . A continuación se comparan diferentes radios iónicos y atómicos de varios elementos y sus tendencias en la tabla periódica.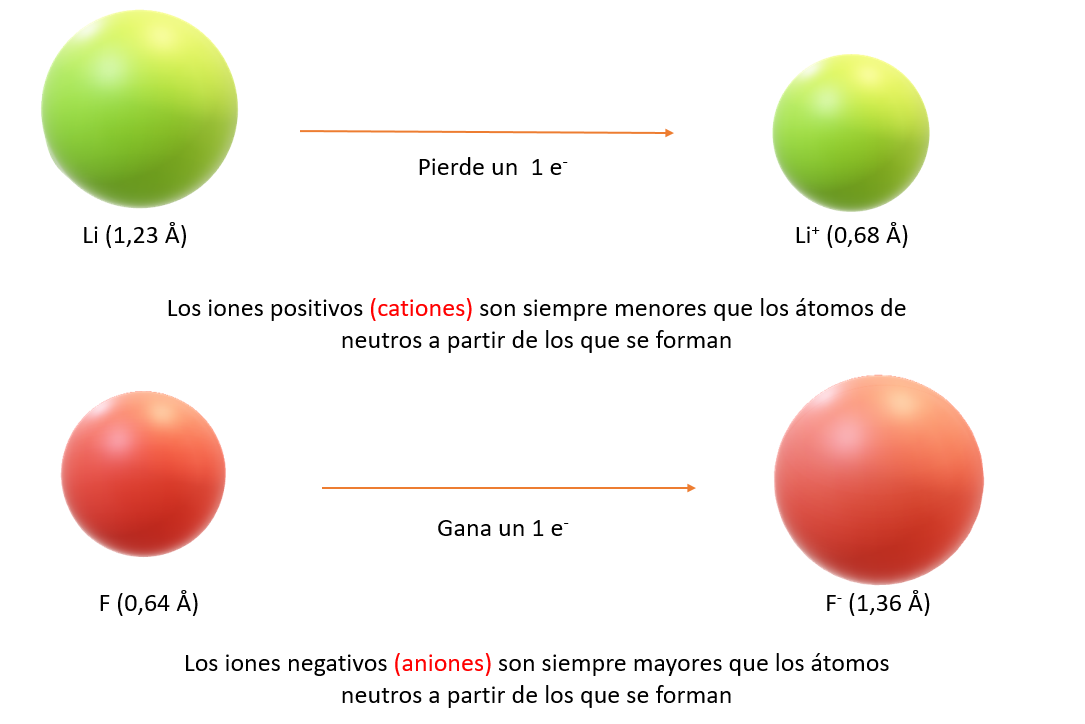
Comparación de radios atómicos y radios iónicos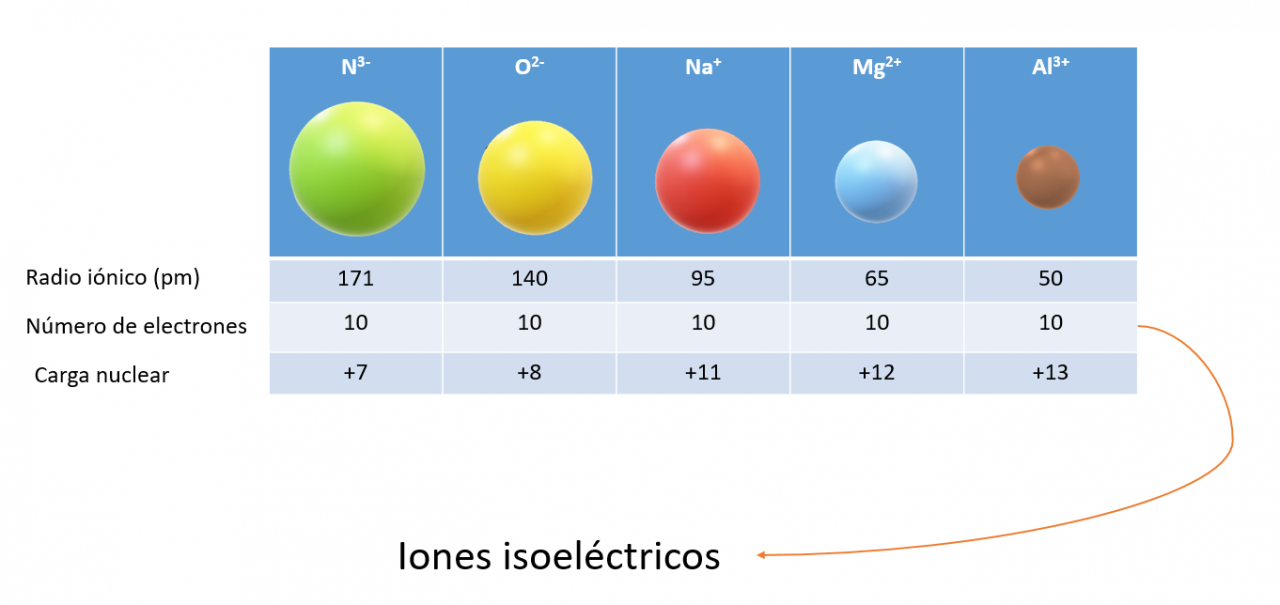
ENERGÍA DE IONIZACIÓN (I)
Energía necesaria para que un átomo pierda un electrón y se convierta en un catión o para que el catión aumente su carga positiva en una unidad. En el cuadro se muestran algunas tendencias de las energías de ionización de algunos elementos. Se muestran las tendencias de las energías de ionización. La energía de ionización por lo general aumenta de izquierda a derecha y disminuye de arriba hacia abajo.
Cuadro 4.1. Valores sucesivos de las energías de ionización (I) para los elementos del sodio al argón (kJ/mol).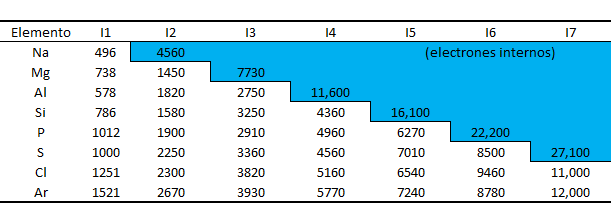
La primera energía de ionización es la energía necesaria para arrancar el electrón más externo de un átomo en estado gaseoso:
Ca (g) + 1ra I → Ca+ (g) + e-
La segunda energía de ionización es la energía necesaria para arrancar el siguiente electrón del ion mono-positivo formado:
Ca+ (g) + 2da I → Ca2+ (g) + e-
AFINIDAD ELECTRÓNICA (AE)
Es la energía que se absorbe o se libera cuanto un átomo o ion gana un electrón. Es el cambio de energía que acompaña al proceso de adición de un electrón a un átomo gaseoso. Los valores de AE se consideran normalmente para 1 mol de átomos.
F (g) + e- → F- (g) + AE (AE= -328 kJ/mol se desprende energía)
Be (g) + e- + AE → Be- (g) (AE= 240 kJ/mol se absorbe energía)
ELECTRONEGATIVIDAD
Capacidad de un átomo de atraer electrones hacía sí en un enlace covalente. Propiedad que combina la energía de ionización y la electroafinidad. Nos informa sobre la tendencia que tienen los átomos de atraer los electrones del enlace. Esta propiedad se cuantifica en valores que van desde 0.7 a 4.0, siendo el flúor el elemento que posee un mayor valor de electronegatividad (ver valores en el cuadro 4.2). Se relaciona en parte con la capacidad que poseen los elementos a formar cationes y aniones y al tipo enlace químico que forman entre sí.
Cuadro 4.2. Valores de las electronegatividades de los elementos representativos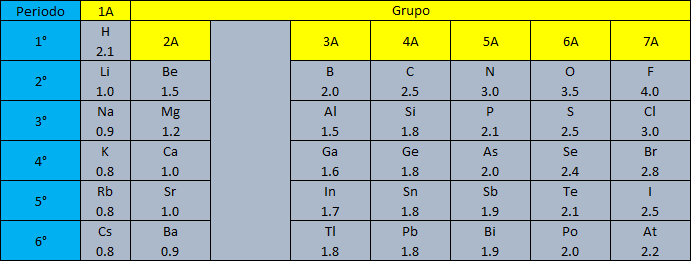
NÚMEROS DE OXIDACIÓN
Es el número de electrones que un átomo cede, gana o comparte cuando forma un enlace químico con otro átomo. Se justifican si en el proceso, adquieren alguna estructura electrónica estable energéticamente.
Para los representativos:
ns2p0
ns2p6
ns1p3
ns2p3