REACCIONES Y ECUACIONES
Los átomos pueden combinarse para formar moléculas. Los compuestos formados por moléculas (compuestos moleculares) por lo regular sólo contienen elementos no metálicos. Las moléculas que contienen dos átomos se llaman moléculas diatómicas. La composición de una sustancia está dada por su fórmula química. Una sustancia molecular se puede representar con su fórmula empírica, que da las proporciones relativas de los átomos de cada clase, pero es más común representarla con su fórmula molecular, que indica los números reales de cada tipo de átomo en una molécula.
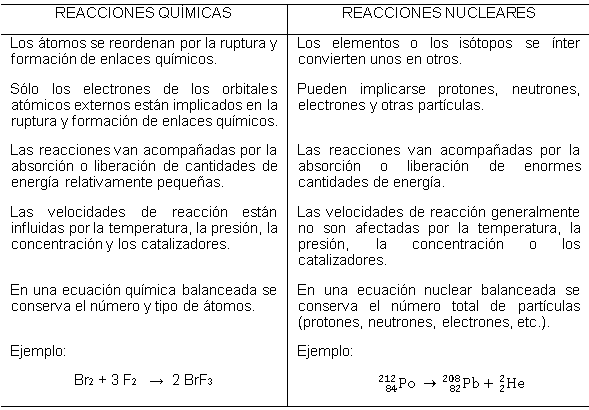
COMPARACIÓN ENTRE REACCIONES QUÍMICAS Y REACCIONES NUCLEARES
REPRESENTACIÓN
Las reacciones químicas se representan mediante Ecuaciones Químicas. Por ejemplo, cuando el hidrógeno (H2) arde, reacciona con el oxígeno (O2) del aire para formar agua (H2O) se puede escribir la ecuación química para esta reacción como sigue:
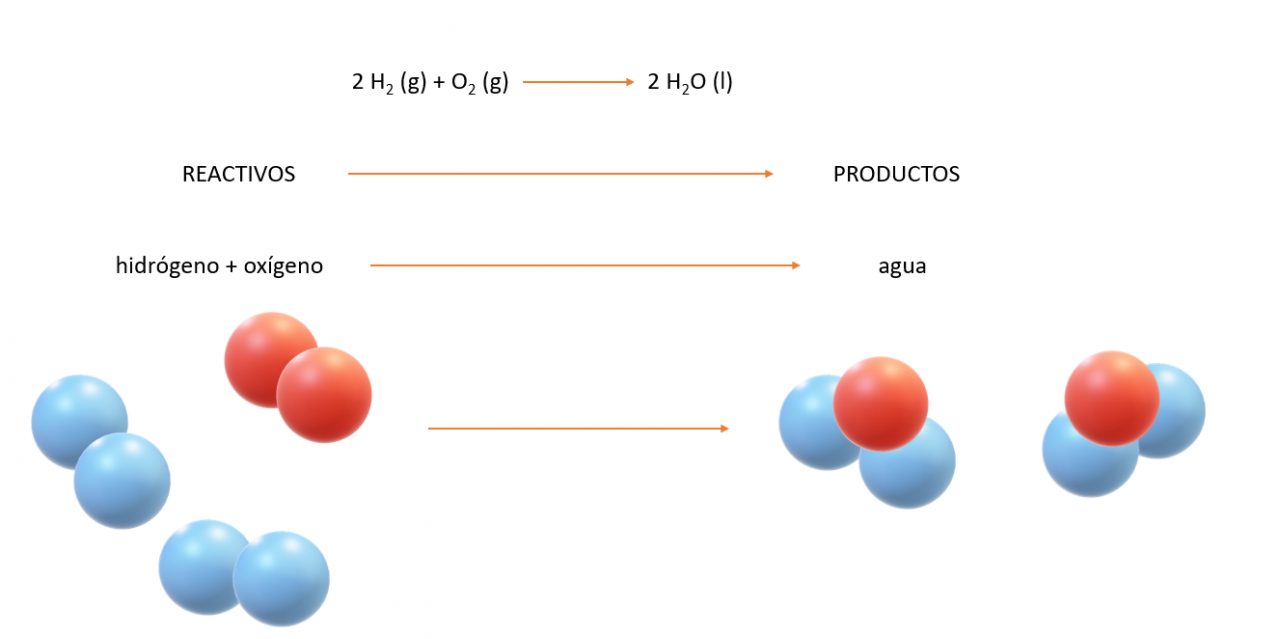
Leemos el signo + “reacciona con” y la flecha como “produce”. Las fórmulas químicas que están a la izquierda de la flecha representan las sustancias de partida, llamadas reactivos. Las fórmulas químicas a la derecha de la flecha representan sustancias que se producen en la reacción, llamadas productos. Los números antepuestos a las fórmulas son coeficientes. (el número 1 normalmente no se escribe.) Es común agregar más información a las fórmulas de las ecuaciones para indicar entre paréntesis el estado físico de cada reactivo y producto. Usamos los símbolos (g), (l), (s) y (ac) para gas, líquido, sólido y disolución acuosa (en agua), respectivamente. Otras condiciones de la reacción pueden indicarse sobre la flecha, por ejemplo, la temperatura o la presión a la que se lleva a cabo la reacción. El símbolo Δ encima de la flecha indica calor.
BALANCEO DE ECUACIONES QUÍMICAS
- Dado que en ninguna reacción se crean ni se destruyen átomos, toda ecuación química debe tener números iguales de átomos de cada elemento a cada lado de la flecha. Si se satisface esta condición, se dice que la ecuación está balanceada. Por ejemplo, en el miembro derecho de la ecuación anterior hay dos moléculas de H2O, cada una de las cuales contiene dos átomos de hidrógeno y uno de oxígeno.
- Al balancear ecuaciones, es importante entender la diferencia entre un coeficiente antepuesto a una fórmula y un subíndice de una fórmula. Nunca deben modificarse los subíndices al balancear una ecuación. En contraste, si colocamos un coeficiente antes de una fórmula lo único que cambiamos es la cantidad y no la identidad de la sustancia; 2H2O significa dos moléculas de agua, 3H2O significa tres moléculas de agua, etcétera. Casi siempre lo mejor es balancear primero los elementos que aparecen en el menor número de fórmulas químicas en cada miembro de la ecuación. Balanceamos cada tipo de átomo sucesivamente, ajustando los coeficientes según era necesario. La estrategia funciona para la mayor parte de las ecuaciones químicas.
Una ecuación química balanceada indica números iguales de átomos de cada elemento en los dos miembros de la ecuación. Las ecuaciones se balancean anteponiendo coeficientes a las fórmulas químicas de los reactivos y de los productos de una reacción, no cambiando los subíndices de las fórmulas químicas.
CLASIFICACIÓN DE REACCIONES
Reacciones de combinación y descomposición:
En las reacciones de combinación, dos o más sustancias reaccionan para formar un producto. Hay muchos ejemplos de tales reacciones, sobre todo aquellas en las que diferentes elementos se combinan para formar compuestos.
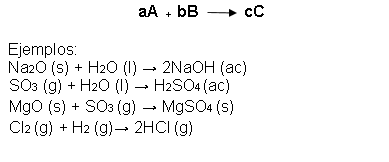
En una reacción de descomposición, una sustancia sufre una reacción para producir dos o más sustancias distintas. Muchos compuestos sufren reacciones de descomposición cuando se calientan.
Reacciones REDOX:
Las reacciones químicas que ocurren con intercambio (transferencia) de electrones, se conocen como reacciones Redox y siempre se originan un cambio en el número de oxidación de las especies involucradas.
Número de oxidación (#Ox)
Corresponde al número de electrones que un átomo pierde, gana o comparte al formar un compuesto. Corresponde a la carga de los iones (para compuestos iónicos), y a un número ficticio para los covalentes o metálicos.
· En una sustancia elemental es 0. Ej: oxígeno O2, yodo en I2, azufre en S o S8, oro en Au, cobre en Cu.
· En un ion monoatómico es igual a la carga del ion. Ej: Al3+, S2-, H+, Cl –
· El #Ox del oxígeno es –2, excepto en los peróxidos (ej: H2O2) es –1.
· El #Ox del hidrógeno es +1, excepto en los hidruros que es –1. Ej: LiH, NaH, CaH2
· Los del grupo I siempre son 1+, del grupo II 2+, el O es 2-, el F es 1-, el B, Al y Ga siempre son 3+.
· Cloro, bromo y Iodo combinados con oxígeno (oxiácidos y oxianiones) tienen #Ox positivos. Si son halogenuros tienen #Ox -1.
· La suma de los #Ox de todos los átomos
· de un compuesto es 0 y en un ion poli atómico es igual a la carga del ion.
Ejemplos:
- El número de oxidación en para el cloro en el HClO4 es:
1(+1) + Cl + 4(-2) = 0
Cl = 8-1 = +7
- El número de oxidación en para el nitrógeno en el NO2- es:
NO2-
N + 2(-2) = -1
N = 4-1 = +3
En toda reacción REDOX una especie gana electrones y otra pierde electrones. Estos procesos se manifiestan con dos hemirreacciones o semirreacciones, una de reducción y otra de oxidación. Ambas se expresan con semiecuaciones.
La oxidación y la reducción suceden simultáneamente. En estas reacciones el número de electrones involucrados es el mismo, no hay pérdida ni ganancia de electrones. La ganancia neta es 0.
La suma de las semirreacciones debe originar la reacción de oxidación-reducción completa.
Oxidación: proceso en el cual una especie pierde electrones, su #Ox aumenta algebraicamente.
Reducción: proceso en el cual la especie gana electrones, su #Ox disminuye.
Agente reductor: especie que reduce a otra y en el proceso pierde electrones, por lo que se oxida.
Agente oxidante: especie que oxida a otra y en el proceso se reduce, ganando electrones.
Las reacciones de combustión son reacciones rápidas que producen una flama. En la mayor parte de las reacciones de combustión que observamos, interviene O2 del aire como reactivo. Cuando quemamos hidrocarburos en aire, éstos reaccionan con O2 para formar CO2 y H2O.
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O(g)
CH3OH(l) + O2(g) → CO2(g) + H2O(g)
Reacciones en Disolución Acuosa
Una disolución es una mezcla homogénea de dos o más sustancias. La sustancia que está presente en mayor cantidad se llama disolvente. Las demás sustancias de la disolución se denominan solutos; y decimos que están disueltas en el disolvente. Existen varios tipos de reacciones en disolución acuosa como precipitación, ácido-base y reducción-oxidación.
Reacciones de intercambio (METÁTESIS): Las reacciones en las que los iones positivos y los iones negativos parecen cambiar de compañero se ajustan a la siguiente ecuación general:
AX + BY → AY + BX
Reacciones de precipitación:
Son reacciones que dan por resultado la formación de un producto insoluble llamado precipitado. Un precipitado es un sólido insoluble que se forma por una reacción en disolución. Se dan reacciones de precipitación cuando ciertos pares de iones con carga opuesta se atraen con tanta fuerza que forman un sólido iónico insoluble.
Pb(NO3)2 (ac) + 2KI (ac) → PbI2(s) + 2KNO3(ac)
Reacciones ácido-base (neutralización):
Los ácidos son sustancias que se ionizan en disolución acuosa para formar iones hidrógeno y así aumentar la concentración de iones H+ (ac). Dado que un átomo de hidrógeno consiste en un protón y un electrón, H+ no es más que un protón. Por ello, es común llamar a los ácidos donadores de protones. Ejemplos de tres ácidos comunes: HCl, HNO3 y CH3COOH. Las bases son sustancias que aceptan (reaccionan con) iones H+. Las bases producen iones hidróxido (OH-) cuando se disuelven en agua. Los hidróxidos iónicos como NaOH, KOH y Ca(OH)2 se cuentan entre las bases más comunes. Cuando éstas se disuelven en agua, se disocian en sus iones componentes, introduciendo iones OH- en la disolución.
Si se mezcla una disolución de un ácido y una de una base, se da una reacción de neutralización. Por ejemplo, cuando se mezcla ácido clorhídrico con una disolución de hidróxido de sodio, ocurre la siguiente reacción:
HCl (ac) + NaOH (ac) → H2O (l) + NaCl (ac)
(ácido) (base) (agua) (sal)
En general, una reacción de neutralización entre un ácido y un hidróxido metálico produce agua y una sal.