EL ENLACE QUÍMICO
Es una fuerza que mantiene unidos a grupos de dos o más átomos, de tal forma que hace que funcionen como una sola unidad. Es la fuerza que existe entre dos átomos, cualquiera sea su naturaleza, debido a la transferencia total o parcial de electrones. De esta forma adquieren ambos una configuración electrónica estable, la que correspondería a un gas noble.
LONGITUD DE UN ENLACE QUÍMICO
Se puede visualizar la energía de los enlaces químicos a partir de las curvas de estabilidad energética, las cuales representan la variación de energía de un sistema formado por dos átomos, A y B, en función de la distancia do que los separa.
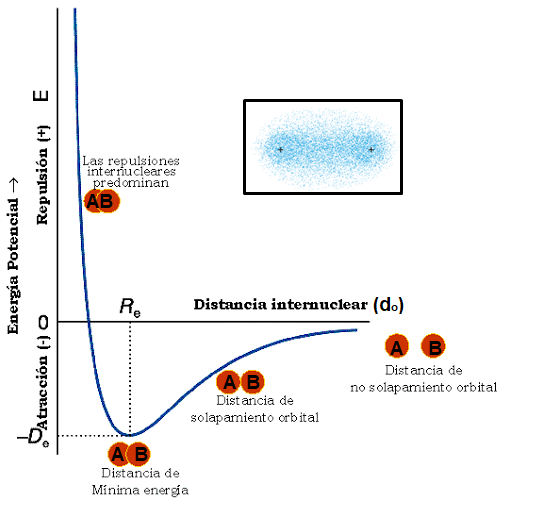
En la figura se considera un sistema formado por dos átomos, A y B. Al principio están tan separados que no pueden ejercer ningún tipo de influencia entre sí, la energía inicial del sistema es cero. Conforme A y B se aproximan mutuamente, empiezan a generarse fuerzas atractivas causadas por el núcleo de A sobre la nube electrónica de B y viceversa, la del núcleo de B sobre la nube electrónica de A. Este acercamiento estabiliza el sistema, haciendo que la energía disminuya hasta un valle de mínima energía, entre menos energía, es decir más abajo esté la curva del valle de mínima energía, más estable será el enlace. Sin embargo, a medida que A y B siguen aproximándose, empiezan a darse las fuerzas repulsivas de una nube electrónica sobre la otra, desestabilizando el sistema, aumentando la energía.
Siempre hay una distancia óptima entre los dos núcleos enlazados en cualquier enlace. La energía potencial del sistema cambia a medida que dos átomos se unen para formar una molécula. Conforme disminuye la distancia entre los átomos, aumenta el traslape entre sus orbitales 1s. A causa del consecuente aumento en la densidad electrónica entre los núcleos, la energía potencial del sistema se reduce; es decir, la fuerza del enlace aumenta, como indica la disminución de la energía en la curva. Sin embargo, la curva también muestra que, si los átomos se acercan mucho, la energía aumenta rápidamente. Este rápido aumento se debe principalmente a la repulsión electrostática de los núcleos, que se vuelve importante a distancias internucleares cortas. La distancia internuclear en el mínimo de la curva de energía potencial corresponde a la longitud de enlace experimentalmente. Así, la longitud de enlace es la distancia a la que las fuerzas de atracción entre cargas distintas (electrones y núcleos) se equilibran con las fuerzas de repulsión entre cargas iguales (electrón-electrón y núcleo-núcleo).
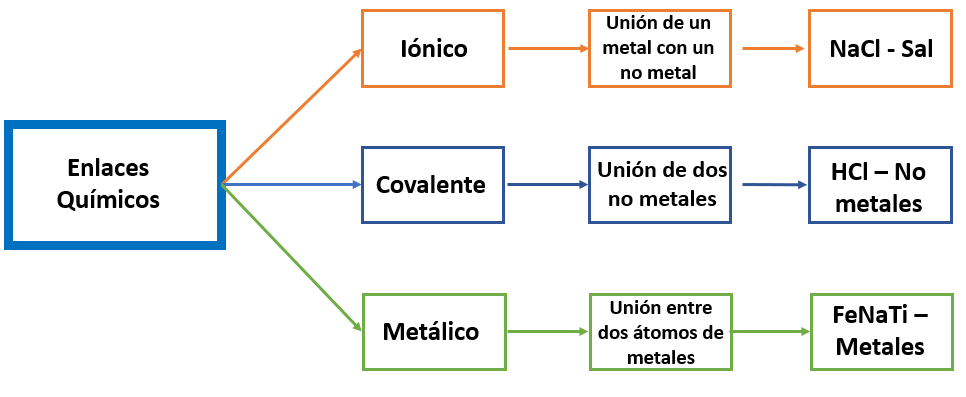
PROPIEDADES Y CARACTERÍSTICAS DEL ENLACE: IÓNICO, COVALENTE Y METÁLICO
Se dice que hay un enlace químico siempre que átomos o iones se unen fuertemente unos a otros entre ellos. Los electrones que participan en los enlaces químicos son los electrones de valencia, es decir los que se encuentran en la capa exterior incompleta de los átomos. Hay tres tipos generales de enlaces químicos: iónicos, covalentes y metálicos, como se muestra en el siguiente esquema de la siguiente figura.